题目内容
明矾石经处理后得到明矾【 KAl(SO4)2·12H2O】。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:

焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是 。
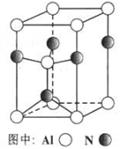
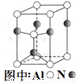
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是 。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1=
一197 kJ/mol;
2SO3(g) △H1=
一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3 (g)与H2O(l)反应的热化学方程式是 ① 。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸 ② t。
(1)S
(2)蒸发结晶
(3)4
(4)Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2
(5)①SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ·mol-1②432
【解析】根据焙烧反应可知还原剂是S,氧化剂是明矾,从滤液中得到硫酸钾晶体的方法是 结晶,一个Al周围有4个N,因此其配位数是4,⑷该电池Al作负极,反应为Al+4OH—-3e- =AlO2-+2H2O,正极反应:NiO(OH)+e-+H2O=Ni(OH)2+OH—,相加得总反应。⑸根据盖斯定律可写出热化学方程式,
根据关系式4KAl(SO4)2·12H2O~9H2SO4
4×474 9×98
948×96% t×98% t=432t。
【考点定位】本题是工业流程题,考查的知识点有:氧化还原反应、物质的分离、电化学、热化学、计算、晶体的结构等。能力层面考查学生的分析、解决问题的能力,用化学知识表述能力、计算能力。





 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
 2SO3(g)
△H1 = -197 kJ /mol;
2SO3(g)
△H1 = -197 kJ /mol;