题目内容
已知25 ℃、101 kPa下,石墨、金刚石燃烧的化学方程式分别为:C(石墨) + O2(g) = CO2(g),1 moL C(石墨) 完全燃烧放热393.51 kJ;C(金刚石) + O2(g) = CO2(g),1 moL C(金刚石) 完全燃烧放热 395.41 kJ。据此推理所得到的下列结论中,正确的是
| A.金刚石比石墨稳定 | B.石墨转化为金刚石是物理变化 |
| C.石墨的能量比金刚石的能量高 | D.由石墨制备金刚石一定是吸热反应 |
D
解析试题分析:根据化学方程式可知,金刚石燃烧放出的热量多,这说明金刚石的总能量高于石墨的总能量,因此由石墨制备金刚石一定是吸热反应。能量越低越稳定,则石墨比金刚石稳定性强。石墨转化为金刚石是化学变化,答案选D。
考点:考查反应热的有关计算、判断和应用
点评:该题是高考中的常见题型和重要的考点,属于中等难度的试题。试题基础性强,侧重对学生基础性知识的巩固与训练,同时兼顾对学生解题能力的培养与训练,有利于培养学生的逻辑推理能力和发散思维能力。

练习册系列答案
相关题目
下列有关热化学方程式的评价合理的是( )
|
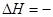 393.51
kJ/mol①;C(金刚石) + O2(g) ==== CO2(g)
393.51
kJ/mol①;C(金刚石) + O2(g) ==== CO2(g)