��Ŀ����
����Ŀ��ij��ɫ��Һ�У�ֻ���ܺ������������е������֣�NH4+��K+��Mg2+��Cu2+��Al3+��NO3-��CO32-��SO42-,����ȡ����100mL��Һ��������ʵ�飺
�ٵ�һ�ݼ�����AgNO3��Һ���а�ɫ����������
�ڵڶ��ݼ�����BaCl2��Һ���а�ɫ������������ϴ�ӡ������������Ϊ6.99g
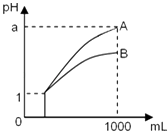
�۵�������εμ�NaOH��Һ����ó�����NaOH��Һ�������ϵ��ͼ����������ʵ�飬�Իش��������⣺

��1������Һ��һ�������ڵ���������_______��
��2��ʵ�����NaOH��Һ����35mL���������ӷ���ʽΪ_______________________________��
��3��ԭ��Һȷ����Mg2+��Al3+��NH4+����n(Mg2+)��n(Al3+)��n(NH4+)=___________��
��4��ʵ�����ӵ�NaOH��Һ��Ũ��Ϊ________��
��5����Һ�д���һ�ֲ���ȷ���������ӣ������ʵ�鷽�����Լ���_________________________��
��6��ԭ��Һ��NO3-��Ũ��Ϊc(NO3-)��c(NO3-)����СŨ��Ϊ_________��
���𰸡� CO32- Al(OH)3+OH-=AlO2-+2H2O 1��1��2 2 mol/L �ýྻ�IJ�˿պȡ������ɫ��Һ�����ڻ��������գ�����ɫ�ܲ��������۲쵽��ɫ���棬��֤������K+����֮���� 0.1mol/L
����������ҺΪ��ɫ������Һ�в���Cu2+���ɢ��г�������������С�Ҳ�Ϊ0�ɵ���Һ�к�Al3+��Mg2+��������Һ�в�����CO32-��������NaOH���г������ɣ�������Һ�в���H+�����������м�β��䣬˵����Һ�к���NH4+����n(Mg(OH)2)=0.01mol����������Ӧ�ļ������Ĺ�ϵ��Mg2+--2NaOH��Al3+--3NaOH��NH4+--NaOH��Al(OH)3-NaOH���ܽ�Al(OH)3����NaOH �����Ϊ5mL������Al3+ת��ΪAl(OH)3����NaOH �����Ϊ15mL�����Բ�����������Mg2+��Ӧ����Mg(OH)2����NaOH �����Ϊ25-15=10mL������c(NaOH)=2��0.01/(10��10-3)=2mol/L����������NaOH �����ɵ�n(Mg2+):n(Al3+):n(NH4+)=1:1:2���ɢڵò����İ�ɫ����ΪBaSO4�����ʵ���Ϊ6.99/233=0.03mol����n(SO42-)=0.03mol����Һ��2n(Mg2+)+3 n(Al3+)+n(NH4+)>2n(SO42-)��������Һ�л�һ������NO3-����һ������K+�������Ϸ������
��ҺΪ��ɫ������Һ�в���Cu2+���ɢ��г�������������С�Ҳ�Ϊ0�ɵ���Һ�к�Al3+��Mg2+��������Һ�в�����CO32-��������NaOH���г������ɣ�������Һ�в���H+�����������м�β��䣬˵����Һ�к���NH4+����n(Mg(OH)2)=0.01mol����������Ӧ�ļ������Ĺ�ϵ��Mg2+--2NaOH��Al3+--3NaOH��NH4+--NaOH��Al(OH)3-NaOH���ܽ�Al(OH)3����NaOH �����Ϊ5mL������Al3+ת��ΪAl(OH)3����NaOH �����Ϊ15mL�����Բ�����������Mg2+��Ӧ����Mg(OH)2����NaOH �����Ϊ25-15=10mL������c(NaOH)=2��0.01/(10��10-3)=2mol/L����������NaOH �����ɵ�n(Mg2+):n(Al3+):n(NH4+)=1:1:2���ɢڵò����İ�ɫ����ΪBaSO4�����ʵ���Ϊ6.99/233=0.03mol����n(SO42-)=0.03mol����Һ��2n(Mg2+)+3 n(Al3+)+n(NH4+)>2 n(SO42-)��������Һ�л�һ������NO3-����һ������K+��
��1��������������֪��ԭ��Һһ��������������CO32-����ȷ�𰸣�CO32-��
��2��ʵ�����NaOH��Һ����35mL�������������������ǿ�Ӧ����ƫ�����������ӷ���ʽΪ��Al(OH)3+OH-=AlO2-+2H2O����ȷ����Al(OH)3+OH-=AlO2-+2H2O��
��3���������Ϸ�����֪��ԭ��Һȷ����Mg2+��Al3+��NH4+����n(Mg2+):n(Al3+):n(NH4+)=1:1:2����ȷ����1��1��2��
��4����������������֪��ʵ�����ӵ�NaOH��Һ��Ũ��Ϊ2mol/L����ȷ����2 mol/L��
��5����������������֪������Һ��һ������Mg2+��Al3+��NH4+������ȷ���Ƿ��м�����������ýྻ�IJ�˿պȡ������ɫ��Һ�����ڻ��������գ�����ɫ�ܲ��������۲쵽��ɫ���棬��֤������K+����֮��������ȷ�����ýྻ�IJ�˿պȡ������ɫ��Һ�����ڻ��������գ�����ɫ�ܲ��������۲쵽��ɫ���棬��֤������K+����֮������
��6���������Ϸ�����֪������Һ�к���Mg2+��Al3+��NH4+��SO42-����n(Mg2+):n(Al3+):n(NH4+)��n(SO42-)=1:1:2��3�����ݵ���غ���ɣ�0.01��2+0.01��3+0.02��1=0.03��2+ n(NO3-)��1, n(NO3-)=0.01mol, c(NO3-)=0.01/0.1=0.1mol/L����ȷ����0.1mol/L��

 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�����Ŀ����ʹ������к͵ζ����ⶨ���۰״���������g100mL��1����
��ʵ�鲽��
��1���������������ƣ���ȡ10.00mLʳ�ð״ף����ձ�����ˮϡ�ͺ�ת�Ƶ�100mL�����������ƣ��ж��ݣ�ҡ�ȼ��ô���״���Һ��
��2������ʽ�ζ���ȡ����״���Һ20.00mL����ƿ�У������еμ�2����ָʾ����
��3����ȡʢװ0.100 0molL��1 NaOH ��Һ�ļ�ʽ�ζ��ܵij�ʼ���������Һ��λ����ͼ��ʾ�����ʱ�Ķ���ΪmL��
��4���ζ�����ʱ��ֹͣ�ζ�������¼NaOH��Һ���ն������ظ��ζ�3�Σ�
��5����ʵ���¼
�ζ�����ʵ�����ݣ�mL�� | 1 | 2 | 3 | 4 |
V����Ʒ�� | 20.00 | 20.00 | 20.00 | 20.00 |
V��NaOH�������ģ� | 15.95 | 15.00 | 15.05 | 14.95 |
�����ݴ���������
�ٰ�ʵ���������ݣ��ɵ�c�����۰״ף�=molL��1����ʽ���㣩�����۰״�������=g100mL��1����ʽ���㣩��
���ڱ�ʵ��ĵζ������У����в�����ʹʵ����ƫ�������д��ţ���
a����ʽ�ζ����ڵζ�ʱδ�ñ�NaOH��Һ��ϴ
b����ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ
c����ƿ�м������״���Һ���ټ�����ˮ
d����ƿ�ڵζ�ʱ����ҡ����������Һ�彦����![]()