题目内容
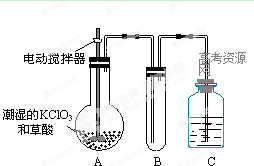
(12分)实验室可用干燥纯净的氨还原氧化铜来制取氮气。根据下列装置图(部分夹持装置略去)回答有关问题:
(1)装置B中盛放的药品是 。
(2)写出装置A中反应的化学方程式______ 。
(3)写出装置C中反应的化学方程式_________,该反应中的氧化剂是 。
(4)收集到的氮气中除了含有少量水蒸气外,还可能含有另外一种气体,确定是否含有该气体的实验方法是 ,实验室收集氮气的方法是 。
(1)碱石灰(其它答案合理也可) (2) Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(3) 2NH3+3CuO 3Cu+N2↑+3H2O CuO
3Cu+N2↑+3H2O CuO
(4)用湿润的红色石蕊试纸靠近玻璃管口,若试纸变蓝色,证明含有该气体 排水集气法
解析试题分析: 装置A用于制备氨气,用固体制备,Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O ,B装置干燥氨气,只能选择碱石灰,C装置用于制备氮气,2NH3+3CuO
CaCl2+2NH3↑+2H2O ,B装置干燥氨气,只能选择碱石灰,C装置用于制备氮气,2NH3+3CuO 3Cu+N2↑+3H2O,氧化剂是CuO,收集到的氮气中有杂质氨气和水蒸气,检验氨气用湿润的红色石蕊试纸靠近玻璃管口,若试纸变蓝色,证明含有氨气,收集氮气用排水集气法。
3Cu+N2↑+3H2O,氧化剂是CuO,收集到的氮气中有杂质氨气和水蒸气,检验氨气用湿润的红色石蕊试纸靠近玻璃管口,若试纸变蓝色,证明含有氨气,收集氮气用排水集气法。
考点:考查氨气的制备和性质

利用下列实验装置进行的相应实验,不能达到实验目的的是
| A.用图1所示装置可制取氨气 |
| B.用图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液 |
| C.用图3所示装置可制取乙烯并验证其易被氧化 |
| D.用图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
S2Cl2是工业上常用的硫化剂,实验室制备的方法有2种: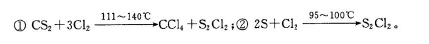 已知在S2Cl2中硫元素显+1价,电子式:
已知在S2Cl2中硫元素显+1价,电子式: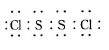 ,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下: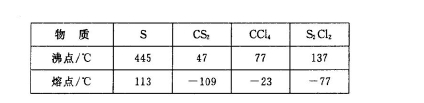
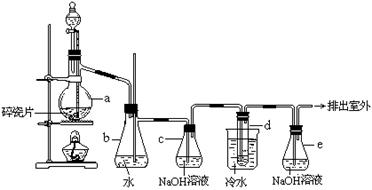
实验室利用下列装置制备 (部分夹持仪器已略去):
回答下列问题:
(1)写出A装置中发生反应的离子方程式
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是
(3)D中冷凝管起到导气和冷凝回流双重作用。这种冷却装置可应用于下列高中化学中 实验。
| A.石油分馏 | B.制备乙烯 | C.制取乙酸乙酯 | D.制取溴苯 |
(5)A装置仪器装配时,整套装置装配完毕后,应先进行 ,再添加试剂。实验完毕,拆除装置时,应先将E中长导管移开液面,目的是
(6)实验过程中,若缺少C装置,则发现产品浑蚀不清,出现该现象的原因可用化学方程式表示为 。实验完毕,当把剩余浓盐酸倒人E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是 (用离子方程式表示)。