题目内容
【题目】I.某反应在体积为4 L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色)。

(1)该反应的化学方程式为____________________
(2)反应开始至2分钟时,B的平均反应速率为__________,A的转化率为________________________
(3)能说明该反应已达到平衡状态的是______________
a.容器内气体的颜色保持不变
b.容器内混合气体的密度保持不变
c.v逆(B)= 2v正(C)
d.容器内混合气体的平均相对分子质量不再改变
II.如图是氢氧燃料电池构造示意图。
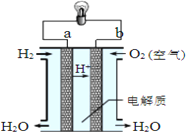
该电池工作时,电子的流向______→_____(填“a”“b”),每生成1 mol H2O则理论上电路中通过的电子数为__________
【答案】2A+B![]() 2C 0.125mol/(Lmin) 40% ad a b 2NA
2C 0.125mol/(Lmin) 40% ad a b 2NA
【解析】
I.(1)从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值之比等于化学计量数之比书写化学方程式;
(2)化学反应速率是单位时间内浓度的变化,据此可求得反应速率;
(3)可逆反应达到平衡状态时,正逆反应速率相等,各组分浓度不再变化,若存在有色物质,则有色物质的颜色也不再变化,据此对各选项进行判断;
II. 氢氧燃料电池中,通入氢气的一极为电源的负极,发生氧化反应,电极反应式为H2-2e-=2H+,通入氧气的一极为原电池的正极,电极反应式为O2+4H++4e-=2H2O,该电池总反应是2H2+O2=2H2O,原电池工作时,电子由负极经外电路流向正极,据此分析。
I. (1)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值之比与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B![]() 2C;
2C;
(2)由图象可以看出,反应开始至2min时,△n(B)=1mol,B的平均反应速率为:![]()
=0.125mol/(Lmin);A的转化率为![]() =40%;
=40%;
(3)a.只有A为有色物质,当容器内气体的颜色保持不变,说明各组分的浓度不再变化,该反应已经达到平衡状态,选项a正确;
b.容器的体积不变,气体的总质量不变,气体的密度始终保持不变,无法判断是否达到平衡状态,选项b错误;
c.v逆(B)= 2v正(C)时正反应速率和逆反应速率不相等,反应没有达到平衡状态,选项c错误;
d.反应为气体体积缩小的反应,容器内混合气体的平均相对分子质量不再改变说明反应已达到平衡状态,选项d正确;
答案选ad;
II.氢氧燃料电池中,通入氢气的一极为电源的负极,发生氧化反应,电极反应式为H2-2e-=2H+,通入氧气的一极为原电池的正极,电极反应式为O2+4H++4e-=2H2O,该电池总反应是2H2+O2=2H2O,原电池工作时,电子由负极经外电路流向正极,即由a通过灯泡流向b;根据反应2H2+O2=2H2O可知,每生成1 mol H2O则理论上电路中通过的电子数为2NA。

 名校课堂系列答案
名校课堂系列答案