��Ŀ����
����Ŀ����������(CaO2)��һ�ְ�ɫ������������ˮ�Ĺ��壬������350 �����ҿ�ʼ�ֽ�ų�����������������ɱ���������㷺���ڹ��߱��ʡ�������������ˮ�����ȷ��档�乤ҵ�Ʊ�����Ҫ�������£�
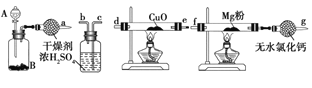
(1)�����Ŀ����______�����̢���û�в��ü��ȴ�ʩ�Ŀ���ԭ����______��______�����̢ڵĻ�ѧ��Ӧ����ʽΪ________________��
(2)���������У���ˮ�����ѭ��ʹ�õ�������______��
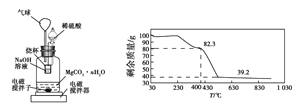
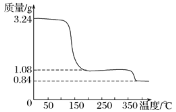
(3)ȡ�����Ƶõ�CaO2��nH2O����������ط��������ȷֽ�ʱ������������¶ȱ仯����������ͼ����ͨ����������������ƾ���(CaO2��nH2O)�Ļ�ѧʽ(д���������) __________________��
���𰸡��ӿ췴Ӧ���� ����H2O2�ֽ� ��ֹ���������ݳ� CaCl2��H2O2��2NH3��nH2O��CaO2��nH2O����2NH4Cl NH4Cl ��ͼ�п�����m(CaO2)=1.08g��m(H2O)=3.24 g��1.08 g=2.16 g������CaO2��nH2O��֪m(CaO2)��m(H2O)=72��18n=1.08 g��2.16 g�����n��8�����Ի�ѧʽΪCaO2��8H2O
��������
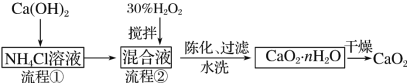
���̢�����NH4Cl��Һ�м���Ca(OH)2��������Ӧ����CaCl2��NH3��H2O�����Һ�������̢ڣ�����Һ�м���30%H2O2�����Ҳ��Ͻ��裬Ŀ���Ǽӿ췴Ӧ���ʣ��õ�����CaO2��nH2O��NH4Cl��Ȼ�»������ˡ�ˮϴ�õ�CaO2��nH2O���壬Ȼ�����õ�CaO2���ݴ˷������
��1�������Ŀ����ʹ��Ӧ���ֽӴ����ӿ컯ѧ��Ӧ���ʣ�����˫��ˮ�ֽ⣬��ˮ�ӷ��������̢���û�в��ü��ȴ�ʩ�Ŀ���ԭ���Ǽ���H2O2�ֽ⡢��ֹ���������ݳ���CaCl2�백�����������ⷢ����Ӧ����CaO2nH2O�������̢ڵĻ�ѧ��Ӧ����ʽΪCaCl2��H2O2��2NH3��nH2O��CaO2��nH2O����2NH4Cl��
��2���ɹ������̷�����֪����ʼ�õ��Ȼ�泥��Ʊ�CaO2nH2Oʱ�������Ȼ�泥�����ѭ��ʹ�õ�������NH4Cl��
��3����ͼ��֪���ֽ�ǰCaO2��nH2O������Ϊ3.24g���ֽ��CaO2������Ϊ1.08g������0.84g��CaO2���ȷֽ�ų������������������ݷ�Ӧ�ķ���ʽ��֪��
CaO2��nH2O![]() CaO2+nH2O
CaO2+nH2O
72+18n 72
3.24 1.0g
��(72��18n)��3.24��72��1.08
���n��8
�ʾ���Ļ�ѧʽΪCaO2��8H2O��

����Ŀ��Ŀǰ�����Ϲ㷺���ð��Ͷ�����̼���¸�ѹ���Ʊ����أ���Ҫ��ӦΪ������
��һ�������ɰ�������� | �ڶ����������������ˮ�������� |
2NH3(l)��CO2(g) | H2NCOONH4(l)
|
���ٷ��� | �������� |
��1��д���Ʊ����ص��ܷ�Ӧ��ѧ����ʽ��____________________________���÷�Ӧ��Ϊ![]() ����
����![]() ______________�������ڡ���С�ڡ����ڡ���
______________�������ڡ���С�ڡ����ڡ���![]() ��
��
��2������˵����ȷ����________________��
A.���ö�����̼�Ʊ������Ǽ�������ЧӦ����Ч����
B.�ڶ�����Ӧ�����������Է�����
C.���Ͷ���е�ˮ̼��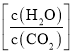 ���������ص�����
���������ص�����
D.��һ����Ӧ�Ļ�ܴ��ڵڶ�����Ӧ
��3����������������ת����ͨ���ö�����̼ת��������ʾ����������̼��ʼŨ��Ϊ![]() ʱ��
ʱ��![]() ��ˮ̼��=0.5��������ƽ��ת�����氱̼��
��ˮ̼��=0.5��������ƽ��ת�����氱̼��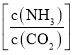 �ı仯�����ʾ��
�ı仯�����ʾ��
��̼��/Ũ�ȱ� | 2.95 | 3.10 | 3.20 | 3.50 |
����ƽ��ת����/% | 56.4 | 57.5 | 57.9 | 60.0 |
��߰�̼���������������أ���Ҫ������ԭ��һ��������Ũ�������ڷ�Ӧ�����ƶ�������_____________����̼��Ϊ3.50ʱ�����״̬�µ��Ʊ������ܷ�Ӧƽ�ⳣ��K=___________.
��4��һ�������£���ͼ�л��ư�������泥�![]() ���ڷ�Ӧ���������ʵ�����ʱ��Ĺ�ϵͼ��
���ڷ�Ӧ���������ʵ�����ʱ��Ĺ�ϵͼ��
 _______________
_______________
��5��ͨ��ֱ������ȼ�ϵ��װ�ã�ʵ���ˡ������ܡ������ã��Ҳ�������Ⱦ�IJ��д��������Ӧ��____________________________.

����Ŀ����һ����ͭ������ĩƽ���ֳ����ȷݣ��ֱ���뵽ͬŨ�ȡ���ͬ�����ϡ�����У���ַ�Ӧ���ռ���NO����������ʣ������������� ���跴Ӧǰ����Һ��������䣬��������ѻ���Ϊ��״��ʱ���������
ʵ����� | ϡ��������/mL | ʣ����������/g | NO�����/L |
1 | 100 | 17.2 | 2.24 |
2 | 200 | 8.00 | 4.48 |
3 | 400 | 0 | V |
����˵����ȷ���ǣ�������
A. ����V=7.84 L
B. ԭ������ĩ������Ϊ25.6 g
C. ԭ������δ������ͭ�����ʵ���֮��Ϊ2��3
D. ʵ��3������Һ����������ʵ���Ũ��Ϊ0.875 molL��1
����Ŀ��ijѧ����0.10 mol/L��NaOH��Һ�ζ�ijŨ�ȵ����ᡣ��¼�������£�
ʵ���� | NaOH��Һ��Ũ�ȣ�mol/L�� | ����NaOH��Һ�������mL�� | ����������Һ�������mL�� |
1 | 0.10 | 19.98 | 20.00 |
2 | 0.10 | 20.02 | 20.00 |
3 | 0.10 | 20.00 | 20.00 |
��1���ζ�ʱ���õ�ָʾ����__________________��
A��Ʒ����Һ B����̪��Һ C��ʯ����Һ
��2����ȥ��ʽ�ζ��������ݵķ���Ӧ���ò���_________��Ȼ�����ἷѹ������ʹ���첿�ֳ�����Һ��

��3���ζ�����ʱ���۾�Ӧע��____________________________________________��
��4���ζ��ﵽ�յ������____________________________________________________��
��5����ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ���Բⶨ�����Ӱ����_______���ƫ�ߡ���ƫ�͡���Ӱ�족����ͬ������ʽ�ζ��ܵζ�ǰ���ӵζ����ӣ��Բⶨ�����Ӱ����_______����ƿ��ˮϴ����û������ϴ�������________��
��6�������������ݣ�������������Ũ��ԼΪ__________________��������λ��Ч���֣���