题目内容
【题目】利用空气催化氧化法除掉电石渣浆(含CaO)上清液中的![]() ,制取石膏(
,制取石膏(![]() )的过程如下:
)的过程如下:
下列说法错误的是( )
A.![]() 属于盐类和纯净物
属于盐类和纯净物
B.过程Ⅱ中,反应的离子方程式为![]()
C.过程Ⅰ后溶液pH减小
D.将10L上清液中的![]() (
(![]() 浓度为
浓度为![]() )转化为
)转化为![]() ,理论上共需要0.15molO2
,理论上共需要0.15molO2
【答案】BD
【解析】
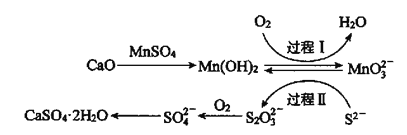
氧化钙溶于水后生成氢氧化钙,与硫酸锰生成氢氧化锰,过程I中,通入氧气将氢氧化锰氧化为![]() ,过程II中,
,过程II中,![]() 将上清液中的S2-氧化为
将上清液中的S2-氧化为![]() ,同时
,同时![]() 被还原为氢氧化锰,再通入氧气将
被还原为氢氧化锰,再通入氧气将![]() 氧化为
氧化为![]() ,经过浓缩结晶,得到石膏。
,经过浓缩结晶,得到石膏。
A.![]() 俗名生石膏,属于结晶水合物,具有固定的组成和性质,属于纯净物里的盐类,A正确;
俗名生石膏,属于结晶水合物,具有固定的组成和性质,属于纯净物里的盐类,A正确;
B.根据转化关系图,过程Ⅱ中S2-与![]() 生成
生成![]() 和Mn(OH)2,根据氧化还原反应得失电子守恒和物料守恒,反应的离子方程式为:4
和Mn(OH)2,根据氧化还原反应得失电子守恒和物料守恒,反应的离子方程式为:4![]() +2S2-+9H2O=
+2S2-+9H2O=![]() +4Mn(OH)2↓ +10OH- ,B错误;
+4Mn(OH)2↓ +10OH- ,B错误;
C.由分析可知过程I中发生反应:2Mn(OH)2+O2+4OH-=2![]() +4H2O,溶液的pH减小,C正确;
+4H2O,溶液的pH减小,C正确;
D.10L上清液中的S2-的物质的量=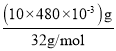 =0.15mol,根据物质转化过程可知,S2-转化为
=0.15mol,根据物质转化过程可知,S2-转化为![]() 过程中需要消耗氧气,
过程中需要消耗氧气,![]() 转化为
转化为![]() 也需要消耗氧气, 在S2-
也需要消耗氧气, 在S2-![]()
![]()
![]()
![]()
![]() 的过程中,硫元素的化合价由-2价变成+6价,S2-共失去0.15mol8=1.2mol电子,1molO2在反应中得到4mol电子,所以将10L上清液中的S2-转化为
的过程中,硫元素的化合价由-2价变成+6价,S2-共失去0.15mol8=1.2mol电子,1molO2在反应中得到4mol电子,所以将10L上清液中的S2-转化为![]()
![]() =0.3mol,D错误。
=0.3mol,D错误。
答案选BD。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目