题目内容
【题目】[选修 2—化学与技术]Ⅰ下列说法不正确的是
A.明矾、漂白粉、臭氧的净水原理相同
B.“血液透析”的原理利用了胶体的性质
C.食品包装中常放入有硅胶和铁粉的小袋,只能防止食物受潮
D.煤炭燃烧、机动车尾气、建筑扬尘等可加重雾霾
Ⅱ水是一种重要的自然资源,是人类赖以生存不可或缺的物质。 水质优劣直接影响人体健康。 海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。 据此,回答下列问题:
(1)天然水灾净化处理过程中需要加入的混凝剂,我们常用的混凝剂有明矾、硫酸铝、硫酸铁,其净水作用的原理是 。
(2)水的净化与软化的区别是水的净化是用混凝剂(如明矾等)将 。
(3)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。 蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (选填“物理变化”或“化学变化”)。
(4)海水除了可以得到淡化水外,还可提取多种化工原料。由海水制备无水氯化镁,主要有以下步骤:
①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是
A.②④⑤③①
B.③②④①⑤
C.③④②⑤①
D.②④③⑤①
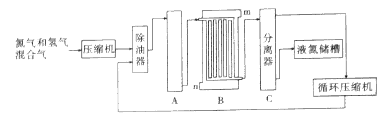
(5)海水电解制得的氢气用于合成氨,某合成氨厂生产流程图如下

①第(1)个设备中先把N2和H2压缩的目的是 。
②在第(3)个设备中用冷却的方法分离出 ,其目的是 。
【答案】ⅠAC
Ⅱ(1)铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体粒子,使其下沉,达到净化目的 ;
(2)水中胶体及悬浮物沉淀下来,而水的软化是降低水中的钙离子和镁离子;
(3)物理变化;
(4)D ;
(5)①使平衡向生成氨的方向移动;
②液态氨 ;
③使平衡右移,提高N2和H2的平衡转化率。
【解析】
试题分析:
Ⅰ、明矾中铝离子水解生成胶体,利用吸附性净化水,而漂白粉、臭氧具有强氧化性,可用于水的杀菌消毒,净水原理不同,故 A 错误;血液为胶体分散性,不能透过半透膜,而小分子、离子等可透过,则“血液透析冶的原理利用了胶体的性质,故 B 正确;硅胶具有吸水性,铁粉具有还原性,所以食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质,故 C 错误;煤炭燃烧、机动车尾气、建筑扬尘等均产生固体颗粒物,雾霾与空气中固体颗粒物,故 D 正确。
Ⅱ、(1)混凝剂是吸附水中的微小悬浮颗粒,并破坏天然水中的其他带异电的胶体粒子,凝聚成较大的颗粒,而快速沉降达到净化目的。因此要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,故答案为:铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的;(2)水的净化是用混凝剂将水中胶体及悬浮物沉淀下来,如明矾中铝离子水解生成胶体,使水中胶体及悬浮物沉淀下来,而水的软化为降低水中钙、镁离子浓度,故答案为:水中胶体及悬浮物沉淀下来,而水的软化是降低水中的钙离子和镁离子;(3)蒸馏是依据混合物中各组分沸点不同而分离的一种方法,适用于除去易挥发、难挥发或不挥发杂质,所以蒸馏是物理变化。(4)因海水中MgCl2的浓度较小,所以要经过富集这一过程:先加熟石灰形成沉淀:MgCl2+Ca(OH)2═Mg(OH)2+CaCl2,然后将沉淀过滤,接着将Mg(OH)2沉淀转化为MgCl2:Mg(OH)2+2HCl═MgCl2+2H2O,这样就实现了MgCl2富集,将溶液蒸发结晶得到六水合氯化镁晶体(MgCl26H2O)(这步是为了得到纯净的MgCl2),又因MgCl2易水解,为防止MgCl2水解的水解,加热六水合氯化镁晶体必须在HCl氛围下中进行:MgCl26H2O![]() MgCl2+6H2O.故答案为:②④③⑤①,选D;(5)①第(1)个设备中先把N2和H2压缩,可使压强增大,有利于使平衡向生成氨气的方向移动,故答案为:使平衡向生成氨气的方向移动;②在第(3)个设备中用冷却方法分离出液氨,生成物浓度降低,可使平衡向正向移动,提高转化率,故答案为:液氨;使平衡右移,提高氮气和氢气的转化率。
MgCl2+6H2O.故答案为:②④③⑤①,选D;(5)①第(1)个设备中先把N2和H2压缩,可使压强增大,有利于使平衡向生成氨气的方向移动,故答案为:使平衡向生成氨气的方向移动;②在第(3)个设备中用冷却方法分离出液氨,生成物浓度降低,可使平衡向正向移动,提高转化率,故答案为:液氨;使平衡右移,提高氮气和氢气的转化率。

【题目】碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等。 工业上用NaOH溶液、水合肼制取碘化钠固体,其制备流程图如下:

已知:N2H4·H2O在100℃以上分解。
(1)已知,在合成过程的反应产物中含有NaIO3,则在合成过程中消耗了3 mol I2,所生成 NaIO3的物质的量为 mol。
(2)写出还原过程中的离子方程式 ;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过 ℃;请选择下列试剂检测所得碘化钠固体中是否含有NaIO3杂质 (选填字母)。
A.FeCl2溶液 B.冰醋酸
C.KI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000g 样品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000mol·L -1 的Na2S2O3,溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3 +I2===Na2S4O2 +2NaI),重复测定2次,所得的相关数据如下表:
测定 序号 | 待测液体积/ mL | 标准液滴定管起点读数/ mL | 标准液滴定管终点读数/ mL |
1 | 25.00 | 0.06 | 24.04 |
2 | 25.00 | 0.02 | 24.02 |
3 | 25.00 | 0.12 | 24.14 |
①操作b中,加入足量的FeCl3溶液时所发生的离子方程式为 。
②加入A物质为 (填名称);滴定终点观察到的现象为 。
③计算该样品中NaI的含量为 。
(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是 。