题目内容
【题目】如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

(1)A中反应的离子方程式为 ,B中Sn极附近会出现的现象_________ ,
C中Zn片上的的电极反应式为 ,发生 反应(填“氧化反应”或“还原反应”)。
(2)A、B、C中铁溶解的速率由快到慢的顺序是_________________ 。
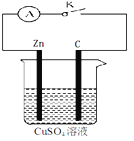
(3)若将质量相等的铁片和铜片用导线相连浸入硫酸铜溶液中构成原电池,如下图,电子由 极

流出(填元素符号),一段时间后,两电极质量相差1.2g,则导线中通过的电子的物质的量为 。
【答案】(1)Fe+2H + =Fe 2+ +H 2 ↑ 有气泡产生 Zn - 2e -= Zn 2+ 氧化反应
(2)B >A>C (3)Fe 0.02mol
【解析】
试题分析:1)A中反应的离子方程式为Fe+2H + =Fe 2+ +H 2 ↑,B中Fe、Sn构成原电池,Fe作负极,发生的反应为Fe-2e- =Fe2-,Sn作正极,电极反应为:2H++2e- = H2 ↑,所以B中Sn极附近会出现的现象有气泡产生,C中Fe和Zn构成原电池,其中Zn作负极,Zn片上的的电极反应式为Zn - 2e -= Zn 2+,发生氧化反应,答案为:Fe+2H + =Fe 2+ +H 2 ↑ 有气泡产生 Zn - 2e -= Zn 2+ 氧化反应;
(2)Fe作原电池的负极时,腐蚀速率最快,作正极时被保护,不易被腐蚀,A、B、C中铁溶解的速率由快到慢的顺序是B >A>C,答案为:B >A>C;(3)若将质量相等的铁片和铜片用导线相连浸入硫酸铜溶液中构成原电池,Fe作负极,发生氧化反应,Cu是正极,发生还原反应,电子由Fe极流出,一段时间后,两电极质量相差1.2g,,设导线中通过的电子的物质的量为x,Fe极减少的质量为56g/mol×0.5xmol=28xg,Cu极增加的质量为64g/mol×0.5xmol=32xg,28xg+32xg=1.2g,算出x=0.02mol,答案为:0.02mol。

【题目】中国环境监测数据显示,颗粒物(PM2.5等)为雾霾过程中影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气。
(1)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(2)现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH,得到两组数据
CO2(g)+H2(g) ΔH,得到两组数据
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
该反应的![]() H 0(填“<”或“>”);若在7500C时,另做一组实验,在2L的恒容密闭容器中加入lmol CO,3mo1 H2O,2mo1 CO2,5mol H2,则此时正 逆(填“<”,“>”,“=”)。
H 0(填“<”或“>”);若在7500C时,另做一组实验,在2L的恒容密闭容器中加入lmol CO,3mo1 H2O,2mo1 CO2,5mol H2,则此时正 逆(填“<”,“>”,“=”)。
(3)一定条件下,某密闭容器中已建立A(g)+B(g) ![]() C(g)+D(g)/span> △H>0的化学平衡,其时间速率图像如图,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是
C(g)+D(g)/span> △H>0的化学平衡,其时间速率图像如图,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是

A.减小压强,同时升高温度,平衡正向移动
B.增加A(g)浓度,同时降低温度,平衡不移动
C.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H1<0
2N2(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g) +2NO2(g)![]() N2(g) +CO2(g) +2H2O(g) △H2<0
N2(g) +CO2(g) +2H2O(g) △H2<0
(4)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO)︰V (NO2)= 。
(5)在不同条件下,NO的分解产物不同。在高压下,NO(即X)在40℃下分解生成两种化合物(即Y、Z),体系中各组分物质的量随时间变化曲线如图所示。写出Y和Z的化学式:

(6) 某研究性学习小组,为研究光化学烟雾消长规律,在一烟雾实验箱中,测得烟雾的主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的消失,记录于右图,根据图中数据,下列推论,最不合理的是

A.NO的消失的速率比RH快
B.NO生成NO2
C.RH及NO2可以生成PAN及O3
D.O3生成PAN