题目内容
11.在标准状况下,若V LNH3中含有的氢原子个数为n,则阿伏加德罗常数可表示为( )| A. | $\frac{vn}{22.4}$ | B. | $\frac{22.4n}{v}$ | C. | $\frac{vn}{5.6}$ | D. | $\frac{22.4n}{3v}$ |
分析 根据n=$\frac{V}{Vm}$计算氨气的物质的量,每个氨气分子含有3个H原子,据此计算H原子的物质的量,再根据N=nNA计算阿伏加德罗常数.
解答 解:标准状况下,VL氨气的物质的量为$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,
每个氨气分子含有3个H原子,故H原子的物质的量为$\frac{V}{22.4}$mol×3=$\frac{3V}{22.4}$mol,
故n=$\frac{3V}{22.4}$mol×NA,解得NA=$\frac{22.4n}{3V}$mol-1,
故选D.
点评 本题考查阿伏伽德罗常数等,比较基础,注意对公式的理解与灵活运用.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
1.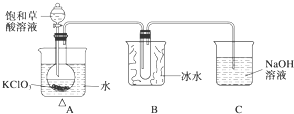 某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).
某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).
已知:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃.
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质.
(1)写出制备ClO2的化学方程式:
KClO3+1H2C2O4═2KHCO3+2ClO2↑
(2)A装置中还缺少的一样仪器名称是温度计,B装置的作用是将ClO2冷凝收集.
(3)C装置吸收尾气后,溶液中含有NaOH、NaClO2、NaClO3等溶质,小组成员认为C中还可能含有Na2CO3,试分析可能的原因是过量的草酸与KHCO3反应:HOOC-COOH+KHCO3=CO2↑+H2O+HOOC-COOK,逸出的CO2与NaOH溶液反应生成Na2CO3,CO2+2NaOH=Na2CO3+H2O;或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3.
(4)小组成员查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:只存在CaC2O4.
②基于假设2,设计实验方案,进行实验.请将实验步骤以及预期现象和结论填入下表.限选实验试剂:1mol•L-1 H2SO4溶液、0.1mol•L-1 HCl溶液、0.01mol•L-1 KMnO4溶液、澄清石灰水.
 某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).
某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).已知:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃.
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质.
(1)写出制备ClO2的化学方程式:
KClO3+1H2C2O4═2KHCO3+2ClO2↑
(2)A装置中还缺少的一样仪器名称是温度计,B装置的作用是将ClO2冷凝收集.
(3)C装置吸收尾气后,溶液中含有NaOH、NaClO2、NaClO3等溶质,小组成员认为C中还可能含有Na2CO3,试分析可能的原因是过量的草酸与KHCO3反应:HOOC-COOH+KHCO3=CO2↑+H2O+HOOC-COOK,逸出的CO2与NaOH溶液反应生成Na2CO3,CO2+2NaOH=Na2CO3+H2O;或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3.
(4)小组成员查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:只存在CaC2O4.
②基于假设2,设计实验方案,进行实验.请将实验步骤以及预期现象和结论填入下表.限选实验试剂:1mol•L-1 H2SO4溶液、0.1mol•L-1 HCl溶液、0.01mol•L-1 KMnO4溶液、澄清石灰水.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入足量0.1 mol•L-1 HCl. | |
| 步骤2:往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4. |
2. 如图所示,①和②为两个体积相同的固定容器,图中“○”和“●”分别表示氢原子和氧原子,则下列说法正确的是( )
如图所示,①和②为两个体积相同的固定容器,图中“○”和“●”分别表示氢原子和氧原子,则下列说法正确的是( )
 如图所示,①和②为两个体积相同的固定容器,图中“○”和“●”分别表示氢原子和氧原子,则下列说法正确的是( )
如图所示,①和②为两个体积相同的固定容器,图中“○”和“●”分别表示氢原子和氧原子,则下列说法正确的是( )| A. | 若①中的H2为1 mol,则②中所含原子总数为3.01×1023个 | |
| B. | ①和②中气体的质量之比为1:8 | |
| C. | H2、O2均能发生化合反应,但不能发生置换反应 | |
| D. | 两容器的温度和压强均相同 |
6.下列说法中有明显错误的是( )
| A. | 对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加 | |
| B. | 升高温度,一般可使活化分子的百分数增大,分子间的碰撞频率提高,因而反应速率增大 | |
| C. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| D. | 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大反应速率 |
16.电化学在日常生活中用途广泛,图①是镁-次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O═Cl-+Mg(OH)2↓,图②是Cr2O72-的工业废水的处理,下列说法正确的是( )

| A. | 图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 | |
| B. | 图②的电解池中,有0.084 g阳极材料参与反应,阴极会有33.6 mL的气体产生 | |
| C. | 图①中发生的还原反应是:Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| D. | 若图①中3.6 g镁溶解产生的电量用以图②废水处理,理论可产生10.7 g氢氧化铁沉淀 |
20.某学生的实验报告所列出的下列数据中合理的是( )
| A. | 用10ml量筒量取7.13ml稀盐酸 | |
| B. | 用托盘天平称量25.20g NaCl | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 中和滴定时用去某浓度的碱溶液21.70mL |
1.9月15日22时04分09秒,长征二号FT2火箭托举着天宫二号空间实验室腾空而起,成功送上太空.该火箭所用的推进燃料偏二甲肼(化学式为C2H8N2),下列说法中正确的是( )
| A. | lmolC2H8N2中含有lmolN2 | |
| B. | 偏二甲肼的摩尔质量为60g | |
| C. | 偏二甲肼是比液氢更环保的燃料 | |
| D. | 偏二甲肼燃烧时能放出大量的热和气体 |
