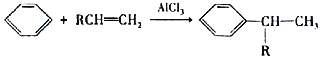题目内容
【题目】锑在工业上应用价值广泛,它的一种提取工艺流程如下,请回答下列问题:
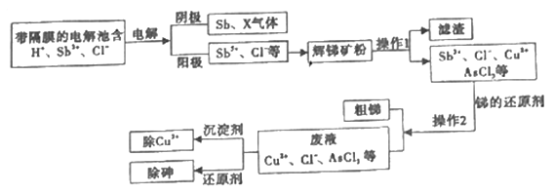
(1)辉锑矿是含锑的重要矿物,其主要成分是Sb2S3其中Sb的化合价是______。
(2)写出阳极区产物与辉锑矿粉主要成分发生反应的化学方程式______。
(3)电解池所用的“隔膜”宜采用______交换膜(填“阳离子”、“阴离子”或“质子”)。为促使Sb3+向阳极迁移加快反应,通常要进行的操作是_________。“电解” 中阴极反应的产物之一X是______。(填化学式)。
(4)为除去操作I所得滤液中的Cu2+,可加入Na2S。若滤液中c(Cu2+)= 0.01mol/L,当溶液中Cu2+恰好完全沉淀时,c(S2-)=______mol/L。 [已知Ksp(CuS)= 8×10-45]
(5)除去废液中的 AsCl3,是用次磷酸钠( NaH2PO2)还原AsCl3,产生了棕色单质砷沉淀和H3PO3。该反应中氧化剂和还原剂的物质的量之比为______,氧化产物是_____________。
(6)若电解池阴极得到1mol X气体,同时电路中转移6mole-,阴极生成的m( Sb)=____ g。
【答案】 +3 Sb2S3+3SbCl5=5SbCl3+3S 阴离子 电解过程中需要不断搅拌 H2 8×10-40 2:3 H3PO3 162.7
【解析】(1)Sb2S3中S的化合价为-2价,根据化合价代数和为0,计算出Sb的化合价是+3。
(2)阳极区产物SbCl3与Sb2S3发生氧化还原反应,得到SbCl3,锑的化合价降低,则硫的化合价一定升高,结合流程图分析,滤液中不含硫元素,氧化产物为硫单质,进入滤渣,所以化学方程式为Sb2S3+3SbCl5=5SbCl3+3S。
(3)阴极发生还原反应生成锑和氢气,Cl-过剩,阳极缺Cl-,故采用阴离子交换膜。为促使Sb3+向阳极迁移加快反应,通常要进行的操作是电解过程中需要不断搅拌。“电解”中阴极发生还原反应,产物之一X是H2。因此本题正确答案为:阴离子;电解过程中需要不断搅拌;H2
(4)根据Ksp(CuS)=c(Cu2+)·c(S2-)=8×10-45,当溶液中Cu2+恰好完全沉淀时,c(Cu2+)≤10-5mol/L,c(S2-)=![]() mol/L=8×10-40 mol/L。
mol/L=8×10-40 mol/L。
(5)AsCl3与NaH2PO2反应生成单质砷沉淀和H3PO3。根据原子守恒,反应物有水参加,化学方程式为:2AsCl3+3NaH2PO2+3H2O=2As↓+3H3PO3+3NaCl+3HCl,该反应中氧化剂为AsCl3,还原剂为NaH2PO2,二者物质的量之比为2:3,氧化产物是H3PO3。
(6)电解池阴极得到1molH2时,转移2mole-,电路中共转移6mole-,则生成Sb时转移4mole-,由Sb3++3e-=Sb知,阴极生成的m(Sb)=![]() mol×121.8g/mol=162.7g。
mol×121.8g/mol=162.7g。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案