题目内容
17.下列各组物质:①漂白粉与稀盐酸 ②漂白粉与浓盐酸 ③铜片与浓硫酸 ④铜片与稀硝酸 ⑤碳酸钙与浓硝酸 ⑥二氧化硫与浓硫酸 ⑦氯化铁溶液与铜片 ⑧氨气与氯气,常温下能发生氧化还原反应的是①②④⑦⑧.(填序号)分析 漂白粉中含有次氯酸钙,在酸性条件下具有强氧化性;浓硫酸和铜在加热条件下反应,硝酸、氯化铁具有强氧化性,可与铜等发生氧化还原反应,氯气和氨气发生氧化还原反应生成氯化氢和氮气,以此解答该题.
解答 解:①漂白粉与稀盐酸反应生成氯气,发生氧化还原反应;
②漂白粉与浓盐酸反应生成氯气,发生氧化还原反应;
③铜片与浓硫酸常温下不反应;
④铜片与稀硝酸常温下发生氧化还原反应生成NO气体;
⑤碳酸钙与浓硝酸发生复分解反应;
⑥二氧化硫与浓硫酸不反应,因S元素化合价相邻,不发生反应;
⑦氯化铁溶液与铜片反应生成氯化亚铁和氯化铜;
⑧氨气与氯气生成氯化氢或氯化铵,同时生成氮气,常用于检验氯气是否泄漏,
则发生氧化还原反应的为①②④⑦⑧.
故答案为:①②④⑦⑧.
点评 本题综合考查元素化合物知识,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意把握物质的性质以及反应条件的判断,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.请回答下列问题:
(1)元素A简单氢化物中A原子的杂化类型是sp3,B、C、D的电负性由小到大的顺序为Na<Cl<F(用所对应的元素符号表示).C的气态氢化物易溶于水的原因是:HF和H2O分子之间能形成氢键.
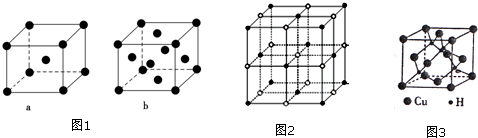
(2)比E少5个质子的原子基态电子排布式为1s22s22p63s23p63d54s1或〔Ar〕3d54s1.元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图1中的a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为2:1.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似
(如图2所示),其中3种离子晶体的晶格能数据如表:
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:TiN>MgO>CaO>KCl.
(4)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6mol σ键和2mol π键断裂.
(5)铜是第四周期最重要的过度元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图3所示,若
CuH的密度为d g•cm-3,阿伏加德罗常数的数值为NA,则Cu+与H-的核间距为$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{65×4}{d{N}_{A}}}$cm(用含d和NA的代数式表示).
(1)元素A简单氢化物中A原子的杂化类型是sp3,B、C、D的电负性由小到大的顺序为Na<Cl<F(用所对应的元素符号表示).C的气态氢化物易溶于水的原因是:HF和H2O分子之间能形成氢键.
(2)比E少5个质子的原子基态电子排布式为1s22s22p63s23p63d54s1或〔Ar〕3d54s1.元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图1中的a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为2:1.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似
(如图2所示),其中3种离子晶体的晶格能数据如表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(4)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6mol σ键和2mol π键断裂.
(5)铜是第四周期最重要的过度元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图3所示,若
CuH的密度为d g•cm-3,阿伏加德罗常数的数值为NA,则Cu+与H-的核间距为$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{65×4}{d{N}_{A}}}$cm(用含d和NA的代数式表示).

8.下列叙述中错误的是( )
| A. | 用水可以鉴别乙醇、苯、和溴苯 | |
| B. | 甲苯与氯气在光照下可发生取代反应,主要生成2,4-二氯甲苯 | |
| C. | 化学式为C7H16的有机物,分子中含有3个甲基的可能结构有3种 | |
| D. | 乙酸丁酯中含乙酸杂质,可以加入饱和碳酸钠溶液洗涤,然后通过分液来去除杂质 |
5.下列有关物质性质的说法错误的是( )
| A. | 热稳定性:HCl>H2S | B. | 原子半径:N>O | ||
| C. | 结合质子能力:S2->Cl- | D. | 酸性:H2SO3>H2SO4 |
12.下列有关生活中的化学,说法不正确的是( )
| A. | 石油裂解、煤的气化、海水制镁都包含化学变化 | |
| B. | 福尔马林用于制备标本是利用了其使蛋白质变性的性质 | |
| C. | 红葡萄酒储藏时间长后变香可能是因为乙醇发生了酯化反应 | |
| D. | 含钙、钡、铁等金属元素的物质有绚丽的颜色,可用于制造焰火 |
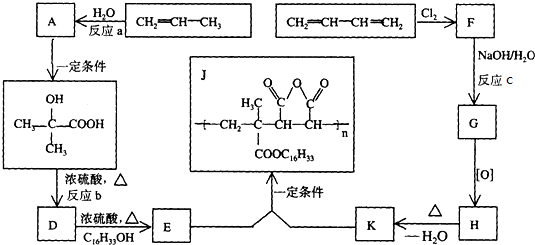
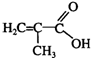 +C16H33OH$→_{△}^{浓硫酸}$
+C16H33OH$→_{△}^{浓硫酸}$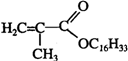 +H2OE+K→J
+H2OE+K→J