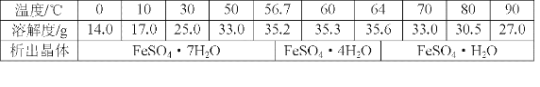
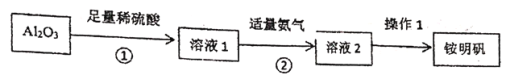
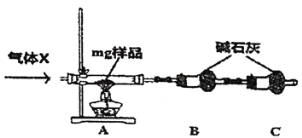
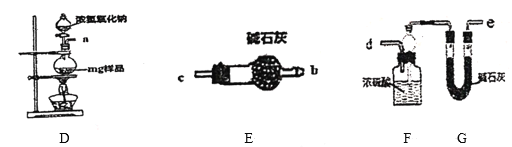
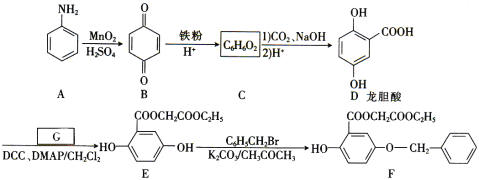
题目内容
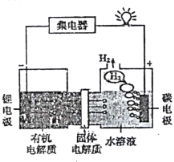
【题目】我国科学家发明的一种可控锂水电池的工作原理如图所示。下列有关说法不正确的是( )
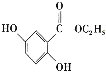
A.电池工作时,锂离子向正极移动B.电池总反应为![]()
C.有机电解质可用水溶液代替D.该装置不仅可提供电能,还可得到清洁的氢气
【答案】C
【解析】
根据图示,锂电极为负极,碳电极为正极,负极上锂发生氧化反应生成锂离子,正极上水发生还原反应生成氢气,据此分析解答。
A、该原电池工作时,电解质中的阳离子锂离子会移向正极,故A正确;
B、金属Li可以和水之间反应生成氢氧化锂和氢气,即反应的方程式为2Li+2H2O═2LiOH+H2↑,故B正确;
C、由于金属Li可以和水之间反应生成氢氧化锂和氢气,但是和有机电解质不反应,所以有机电解质不可用水溶液代替,故C错误;
D、该原电池是将化学能转化为电能的装置,装置不仅可提供电能,并且反应产物有氢气,属于清洁能源,故D正确;
故选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目