题目内容
【题目】研究和开发CO、CO2的应用对构建人类的生态文明建设有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为__________。
(2)电子工业中使用的一氧化碳常以甲醇为原料CH3OH=CO + 2H2,该反应是经历脱氢、分解两步反应实现的。
ⅰ(脱氢):2CH3OH ![]() HCOOCH3 + 2H2
HCOOCH3 + 2H2
ⅱ(分解): ……
①ⅰ(脱氢)反应的机理可以用下图表示:图中中间产物X的结构简式为________。

②写出ⅱ(分解)反应的化学方程式____________。
(3)科学家们积极探讨控制温室气体CO2的排放,减缓全球变暖措施和方法。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为:____________。
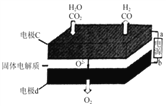
②固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。写出电极c上发生的电极反应式:_________、_________。
(4)催化剂可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图。
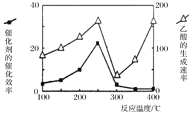
在250-300℃过程中影响速率的主要因素是___________;在300-400℃过程中影响速率的主要因素是___________。
【答案】 Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H =-28.5 kJ·mol-1 HCHO HCOOCH3 ![]() CH3OH + CO Li2CO3+Li2SiO3
CH3OH + CO Li2CO3+Li2SiO3![]() CO2↑+Li4SiO4 CO2+2e-===CO+O2- H2O+2e-===H2+O2- 催化剂 温度
CO2↑+Li4SiO4 CO2+2e-===CO+O2- H2O+2e-===H2+O2- 催化剂 温度
【解析】分析:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1,
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1,由盖斯定律①-②×3得到热化学方程式;
(2)①根据分解反应过程和反应机理图示分析判断,中间产物为甲醛;②反应为分解反应,根据分解反应过程来判断;
(3)①根据题干信息,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒进行解答;②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,水中的氢元素化合价降低被还原,电极反应式为:H2O+2e-=H2+O2-;
(4)在250-300℃过程中,催化效率的降低,导致反应速率也降低,催化剂是影响速率的主要因素;而在300-400℃时,催化效率低且变化程度较小,但反应速率增加较明显,故温度是影响速率的主要因素。
详解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H =-28.5 kJ·mol-1,
因此,本题正确答案是:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H =-28.5 kJ·mol-1;
(2)①根据图示和分解反应过程,结合原子守恒分析,甲醇去氢后得到的是甲醛,因此,本题正确答案是:HCHO;
②第二步为分解反应,甲酸甲酯分解得到甲醇和一氧化碳,化学方程式为:HCOOCH3 ![]() CH3OH + CO,因此,本题正确答案是:HCOOCH3
CH3OH + CO,因此,本题正确答案是:HCOOCH3 ![]() CH3OH + CO;
CH3OH + CO;
(3)①在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可以知道产物还有Li2SiO3,所以700℃时反应的化学方程式为:Li2CO3+Li2SiO3![]() CO2↑+Li4SiO4,因此,本题正确答案是:Li2CO3+Li2SiO3
CO2↑+Li4SiO4,因此,本题正确答案是:Li2CO3+Li2SiO3![]() CO2↑+Li4SiO4;
CO2↑+Li4SiO4;
②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,水中的氢元素化合价降低被还原,电极反应式为:H2O+2e-=H2+O2-,因此,本题正确答案是:CO2+2e-═CO+O2-;H2O+2e-=H2+O2-;
(4)在250-300℃过程中,催化剂是影响速率的主要因素;而在300-400℃时,催化效率低且变化程度较小,但反应速率增加较明显,因此该过程中温度是影响速率的主要因素,温度越高,反应速率越大.因此,本题正确答案是:催化剂 ; 温度。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案