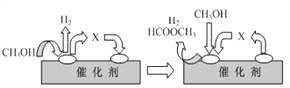
题目内容
【题目】某同学设计下列方法对A盐的水溶液进行鉴定:
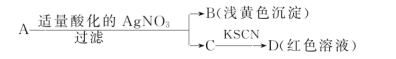
由此得出的结论中,不正确的是
A.D溶液中存在Fe(SCN)3 B.滤液C中有Fe3+
C.B为AgBr D.A一定是FeBr2
【答案】D
【解析】
试题A.由于C溶液中加入KSCN溶液,溶液变为血红色,则证明C中含有Fe3+,Fe3+与SCN-发生反应形成Fe(SCN)3,所以在D溶液中存在Fe(SCN)3,正确。 B.Fe3+与SCN-发生反应形成Fe(SCN)3,滤液C中加入KSCN溶液,溶液变为血红色,则证明在C中含有Fe3+,正确。C.向A溶液中加入酸酸化的AgNO3溶液,产生浅黄色沉淀,则不溶性的沉淀是AgBr,原溶液中含有Br-,正确。D.根据题意可知在原溶液中含有Br-,由于在酸性条件下NO3-表现氧化性,会把Fe2+氧化为Fe3+,在反应后的溶液C中含有Fe3+,可能是原溶液中含有的,也可能是氧化产生的,所以A可能是FeBr2,也可能是FeBr3,错误。

练习册系列答案
相关题目
【题目】某同学用如下装置进行实验①和②,在相同时间内,记录现象如下(溶液的温度变化均不明显)。
实验装置 | 实验序号 | 电极材料 | 实验现象 |
| ① | 铂 | 两极均产生大量无色气泡, 两极区的溶液均未见白色浑浊 |
② | 石墨 | 两极均产生大量无色气泡, 阴极区未见白色浑浊, 阳极区产生白色浑浊,分离出该白色固体,加酸溶解,产生气泡 |
根据实验现象,下列说法正确的是
A. ①②中,阴极的电极反应式:2H2O-4e == O2↑+ 4H+
B. ②中,白色浑浊的主要成分是Ca(OH)2
C. ②中,产生白色浑浊的主要原因是电解过程消耗水
D. ②中,产生白色浑浊与阳极材料被氧化生成CO32有关