题目内容
【题目】如图所示装置为新型电池,放电时电池的总反应式为NaBr3+2Na2S2=3NaBr+Na2S4,下列说法正确的是( )
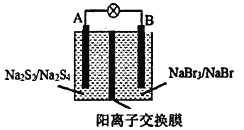
A.放电时A电极的反应式为2Na2S2+2e﹣═Na2S4+2Na+
B.放电时Na+从左向右通过阳离子交换膜
C.外电路中的电流方向为A→灯泡→B
D.放电时B电极发生氧化反应
【答案】B
【解析】
A、由放电时电池的总反应式为NaBr3+2Na2S2=3NaBr+Na2S4可知,A为原电池的负极,反应为2S22-﹣2e﹣=S42-,故A错误;
B、放电时Na+从负极通过阳离子交换膜移向正极,A为原电池的负极,B为原电池的正极,所以Na+从左向右通过阳离子交换膜,故B正确;
C、A为原电池的负极,B为原电池的正极,所以电流方向为B→灯泡→A,故C错误;
D、B为原电池的正极,发生还原反应,故D错误;
故选:B。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】Ⅰ.中和热的测定是高中重要的定量实验。取50mL 0.55mol/L的NaOH溶液与50mL 0.25mol/L的硫酸溶液置于如图所示的装置中进行中和热的测定实验,回答下列问题:

(1)仪器A的名称是____________。
(2)实验测得的数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
2 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。ΔH=__________ ( 取小数点后一位)。
(3)若改用60mL 0.25mol·L-1H2SO4和50mL 0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量______,若实验操作均正确,则所求中和热_____。
II、某课外活动小组拟探究H+浓度对MnO2与H2O2反应速率的影响。
(4)现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间。
实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
水的体积/mL | 15 | 14.5 | V4 | 13.5 |
所需时间t/s | t1 | t2 | t3 | t4 |
已知酸条件下时:MnO2+H2O2+2H+=Mn2++O2↑+2H2O
①实验I发生反应的化学方程式为 ________,实验II中MnO2的作________。
②上表中V1=_______mL,V3=_______mL。
③若实验测得t2>t3>t4,则可得出的实验结论是______。



