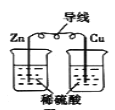
题目内容
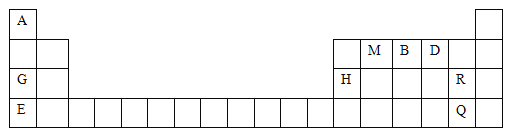
【题目】A、B、C、D、E五种短周期主族元素,原子序数依次增大,A原子的最外层上有4个电子;C的阴离子和D的阳离子具有相同的电子层结构,两种元素的单质反应,可生成一种淡黄色的固体F,E的L层电子数等于K、M层电子数之和。
(1)E在元素周期表中的位置__________,B常见氢化物的电子式为_______;F的电子式为________。
(2)B、C、D、E元素的简单离子半径由大到小的顺序为__________________ (用离子符号表示,下同)。A、B、C元素气态氢化物的稳定性由强到弱的顺序为_______________。
(3)已知A、E两种元素形成的化合物X,X结构与干冰相似,属于_________ (填“离子”或“共价”)化合物。
(4)用电子式表示D与E化合形成D2E的过程:_____________________。
(5)C和E分别能与氢形成18个电子的化合物,这两种化合物发生反应,可生成E单质,其反应的化学方程式为_____________。
【答案】第三周期第ⅥA族 ![]()
![]() r(S2-)>r(N3-)>r(O2-)>r(Na+) H2O>NH3>CH4 共价
r(S2-)>r(N3-)>r(O2-)>r(Na+) H2O>NH3>CH4 共价 ![]() H2O2+H2S =S↓ +2H2O
H2O2+H2S =S↓ +2H2O
【解析】
A、B、C、D、E五种短周期主族元素,原子序数依次增大,A原子的最外层上有4个电子,为第IVA族元素;C的阴离子和D的阳离子具有相同的电子层结构,两种元素的单质反应,生成一种淡黄色的固体F,则C是O元素、D是Na元素,F为Na2O2;A原子序数小于C,则A是C元素,B原子序数大于A而小于C,则B是N元素;E的L层电子数等于K、M层电子数之和,则M层为6个电子,为S元素,再结合元素周期表结构、物质结构及性质分析解答。
根据上述分析可知,
(1)E为S元素,在元素周期表中的位置为:第三周期第ⅥA族;B为N元素,常见氢化物为氨气,其电子式为:![]() ;F为过氧化钠,含有离子键与非极性键,其电子式为
;F为过氧化钠,含有离子键与非极性键,其电子式为![]() ,
,
故答案为:第三周期第ⅥA族;![]() ;
;![]() ;
;
(2)电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以B、C、D、E元素的简单离子半径由小到大的顺序为S2- > N3- > O2- >Na+;同周期元素中,从左到右非金属性依次增强,又元素非金属性越强,其气态氢化物的稳定性越好,所以A、B、C元素气态氢化物的稳定性由强到弱的顺序为H2O>NH3>CH4,
故答案为:S2- > N3- > O2- >Na+;H2O>NH3>CH4;
(3)干冰为二氧化碳的固体形态,A、E两种元素形成的化合物X为CS2,其结构与干冰相似,则该化合物属于共价化合物,
故答案为:共价;
(4)D是Na元素,E为S元素,两者结合形成离子化合物,其用电子式表示硫化钠的形成过程为:![]() ,
,
故答案为:![]() ;
;
(5)C与氢形成可形成过氧化氢18电子化合物,E和氢元素形成硫化氢18电子化合物,两者发生氧化还原反应,生成硫单质与水,其化学方程式为:H2O2+H2S =S↓ +2H2O,
故答案为:H2O2+H2S =S↓ +2H2O。