题目内容
【题目】元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、M、Q、R分别代表某一化学元素。请用所给元素回答下列问题:
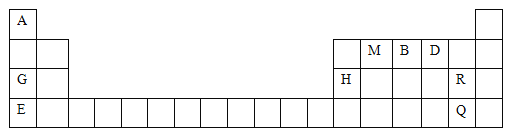
(1)写出下列元素的符号:B______、D________、H________。
(2)M元素的原子结构示意图为__________________。
(3)Q元素在元素周期表中的位置为_____________。Q的单质常温下为_________色液体,氧化性比R的单质氧化性__________(填“强”或“弱”)。
(4)G与E中金属性较强的是_________(填元素符号),其理由是__________________。
【答案】N O Al  第四周期ⅦA族 深红棕 弱 K K的原子半径大于Na,K比Na更容易失电子
第四周期ⅦA族 深红棕 弱 K K的原子半径大于Na,K比Na更容易失电子
【解析】
根据元素在周期表的位置判断元素,然后根据元素的位置与原子结构的关系可画出原子结构示意图、利用元素及化合物知识判断其单质在通常情况下的存在状态,利用同一主族元素的性质递变规律判断单质的氧化性的强弱及元素金属性强弱的原因,据此分析解答。
(1)根据元素在周期表的位置可确定B是N元素,D是O元素,H是Al元素;
(2)M元素是C元素,原子核外有6个电子,电子排布为2、4,故其原子结构示意图为![]() ;
;
(3)根据元素的位置与原子结构的关系可知R是Cl元素,Q元素是Br元素,在元素周期表中的位置为第四周期ⅦA族;Q的单质常温下为液色液体,由于同一主族的元素从上到下原子半径逐渐增大,获得电子的能力逐渐减弱,所以单质的氧化性逐渐减弱,所以Br2的氧化性比Cl2的单质氧化性弱;
(4)根据元素在周期表的位置可知G是Na元素,E是K元素,由于二者在周期表中位于同一主族,随着原子序数的增大,原子半径K>Na,原子半径越大,元素原子失去电子的能力就越强,元素的金属性就越强,所以金属性较强的是K元素。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案