题目内容
【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是____和____(填分子式)。
(2)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=_______________kJ·mol–1
(3)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
pH t /min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的微粒是____。
②在30 ℃、pH=4.0条件下,O3的分解速率为_____mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为_____(填字母)。
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0
(4)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
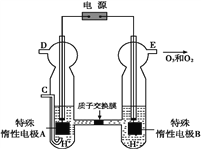
①图中阴极为____(填“A”或“B”),其电极反应式为_________________________。
②若C处通入O2,则A极的电极反应式为________,右室pH变化___________(填升高、降低、不变)
【答案】 I2 O2 +74.8 OH- 1.00×10-4 b、a、c A 2H++2e-=H2↑ O2+4H++4e-=2H2O 降低
【解析】(1)O3与KI溶液反应生成的两种单质,根据原子守恒可知应该是I2、O2。(2)已知
①2H2O(l)=2H2(g)+O2(g) ΔH1=+571.6kJ·mol–1
②C(s)+H2O(g)=CO(g)+H2(g)ΔH2=+131.3kJ·mol–1
③CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则根据盖斯定律可知③-②即得到反应CH4(g)=C(s)+2H2(g)的焓变ΔH=+74.8kJ·mol–1;
(3)①pH增大能加速O3分解,pH越大,氢氧根浓度越大,所以表明对O3分解起催化作用的微粒是OH-。②根据表中数据可知在30℃、pH=4.0条件下,O3的分解速率为=0.0108mol/L÷108min=1.00×10-4mol/(Lmin);③由表中数据可知,40℃、pH=3.0时,所需时间在31min~158min之间;10℃、pH=4.0时,所需时间>231min;30℃、pH=7.0时,所需时间<7min,则分解速率依次增大的顺序为b、a、c;(4)①由图可知,B极生成O2、O3,B极发生氧化反应,电解池阳极发生氧化反应,故A为阴极,电极反应为2H++2e-=H2↑;②C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O;右室氢氧根放电,破坏水的电离平衡,氢离子浓度增大,pH降低。



