题目内容
将一定量的锌与100mL18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的c(H+)=0.1mol·L-1,则下列叙述中错误的是
| A.气体A为SO2和H2的混合物 |
| B.气体A中SO2和H2的体积比为4:1 |
| C.反应中共消耗Zn 97.5g |
| D.反应中共转移3mol电子 |
B
解析试题分析:生成气体的物质的量为33.6L÷22.4L/mol=1.5mol,溶液剩余硫酸的物质的量为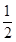 ×1L×0.1mol/L=0.05mol,参加反应的n(H2SO4)=0.1L×18.5mol/L-0.05mol=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,设反应生成xmolSO2,ymolH2,
×1L×0.1mol/L=0.05mol,参加反应的n(H2SO4)=0.1L×18.5mol/L-0.05mol=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,设反应生成xmolSO2,ymolH2,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
x+y=1.5、2x+y=1.8
解之得 x=0.3,y=1.2
所以反应会生成0.3mol的二氧化硫和1.2mol的氢气。
A、由以上计算可知,气体A为SO2和H2的混合物,A正确;B、气体A为SO2和H2的混合物,且V(SO2):V(H2)=1:4,B不正确;C、反应中共消耗1.5mol锌,质量是1.5mol×65g/mol=97.5g,C正确;D、在反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O中,生成0.3mol的二氧化硫转移电子为0.6mol,反应Zn+H2SO4(稀)=ZnSO4+H2↑中,生成1.2mol氢气转移电子2.4mol,所以反应中共转移3mol电子,故D正确,答案选B。
考点:考查锌与硫酸反应的有关计算

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH= 2Fe(OH)3 + 2KI; 3I2 + 6KOH=" 5KI" + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:
4NaClO  3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是:
| A.氧化性(酸性溶液):FeCl3>Co(OH)3>I2 |
| B.还原性(碱性溶液):Fe(OH)2>I2>KIO3 |
| C.热稳定性:NaCl>NaClO4>NaClO |
| D.酸性(水溶液):HSCN>H2CO3>HCN |
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)
| A.NaBH4既是氧化剂又是还原剂 |
| B.NaBH4是氧化剂,H2O是还原剂 |
| C.硼元素被氧化,氢元素被还原 |
| D.被氧化的元素与被还原的元素质量之比为1∶1 |
已知下列反应:Co2O3+6HCl(浓)=2CoCl2+Cl2↑+3H2O(Ⅰ);5Cl2+I2+6H2O=10HCl+2HIO3(Ⅱ)。下列说法正确的是 ( )。
| A.反应Ⅰ中HCl是氧化剂 |
| B.反应Ⅱ中Cl2发生氧化反应 |
| C.还原性:CoCl2>HCl>I2 |
| D.氧化性:Co2O3>Cl2>HIO3 |
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是 ( )。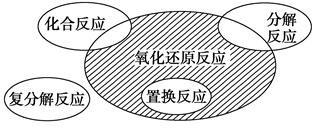
| A.Cl2+2KBr=Br2+2KCl |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Na2O2+2CO2=2Na2CO3+O2 |
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法不正确的是( )
| A.Cu与Cu2O的物质的量之比为2∶1 |
| B.硝酸的物质的量浓度为2.6 mol·L-1 |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol |
亚硝酸钠是一种防腐剂和增色剂,但在食品中过量时会对人体产生危害。其在酸性条件
下会产生NO和NO2。下列有关说法错误的是( )
| A.NaNO2既具有氧化性又具有还原性 |
| B.食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害 |
| C.NaNO2和胃酸作用的离子方程式为: 2NO2—+2H+=NO↑+NO2↑+H2O |
| D.1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol |
下列物质分别与水发生反应:①Na、②NaH、③NO2、④Cl2、⑤SO3、
⑥Na2O2,其中属于氧化还原反应,但水既不是氧化剂又不是还原剂的是( )
| A.①③⑥ | B.②⑤ | C.③④⑥ | D.④⑤⑥ |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,下列说法正确的是( )
| A.由反应可知,氧气、氯气均为氧化产物 |
| B.若化学计量数a=8,则该反应转移电子数为12e- |
| C.若b确定,则方程式中其他物质的化学计量数均能确定 |
| D.若氯酸分解所得混合气体,1 mol混合气体质量为51.5 g,则反应方程式可表示为:5HClO3=O2↑+Cl2↑+3HClO4+H2O |