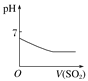
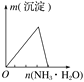
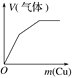
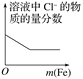
题目内容
【题目】现有A、B、C、D、E五种元素,其原子序数依次增大。C元素的单质是生活中最常见的助燃剂。A与C形成的一种化合物是引起温室效应的主要气体。D与C同主族。E是我国最早使用的合金的主要成分。根据上述信息回答下列问题:
(1)写出E元素外围电子排布式:_______________。
(2)A、B、C三种元素中电负性最大的是:___________,
第一电离能最大的是:_________(填元素符号)。
(3)D元素气态氢化物的分子构型是:__________,其键角______109°28′(填“大于”“小于”或“等于”)。D元素在其最高价氧化物分子中的杂化方式为:_________。
(4)E元素形成的单质晶体类型为:___________晶体,假设其原子半径为r pm,NA为阿伏加德罗常数,则其晶体密度的表达式为ρ=________________g/cm3。
【答案】 3d104s1 O N V形(角形、折线形) 小于 sp3 金属 ![]()
【解析】现有A、B、C、D、E五种元素,其原子序数依次增大。C元素的单质是生活中最常见的助燃剂,则C为氧元素,A与C形成的一种化合物是引起温室效应的主要气体,则A是碳元素,A与C形成的化合物是二氧化碳,D与C同主族,则D为硅元素,B为氮元素,E是我国最早使用的合金的主要成分,则E为铜。(1)E是铜元素,原子序数为29,其电子排布式为:1s22s22p63s23p63d104s1,外围电子排布式为:3d104s1;(2)同周期元素从左到右元素非金属性逐渐增强,电负性逐渐增强,则C、N、O三种元素中电负性最大的是O元素,由于氮元素2p轨道为半充满的稳定状态,故第一电离能最大的是N;(3)D元素气态氢化物的分子构型是:V形(角形、折线形),其键角小于109°28′;Si元素在其最高价氧化物分子二氧化硅中每个硅原子与四个氧原子形成四个Si-O,因此,Si的杂化方式是sp3杂化;(4)铜元素形成的单质晶体类型为金属晶体,假设其原子半径为r pm,NA为阿伏加德罗常数,晶胞中,铜原子的个数为8×![]() +6×
+6×![]() =4,设晶胞边长为4rcm,则体对角线为4r,则体积为(
=4,设晶胞边长为4rcm,则体对角线为4r,则体积为(![]() )3,则ρ=
)3,则ρ=![]() 。
。

【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。
相关数据如下:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡过程体系的能量变化 | |||
CO | H2O | CO2 | H2O | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 容器①中CO反应速率等于H2O的反应速率
D. 平衡时,两容器中CO2的浓度相等