题目内容
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一.
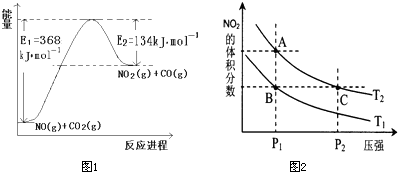
(1)图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图1,请写出NO2和CO反应的热化学方程式
又知:N2 (g)+O2 (g)=2NO(g)△H=+180kJ?mol-1;2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ?mol-1;则反应:2NO(g)+2CO2(g)?N2(g)+2CO2(g)的△H=
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2 (g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
①写出该反应的平衡常数表达式:K=
,已知:K300℃>K350℃,则该反应是
②反应达到平衡后,NO2的转化率为
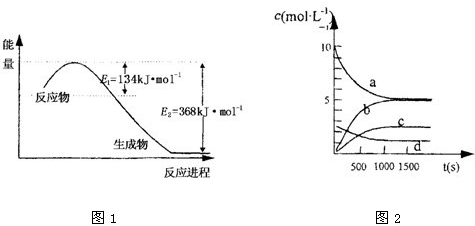
③如图2中表示N2O5 的浓度的变化曲线是

(1)图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图1,请写出NO2和CO反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
;又知:N2 (g)+O2 (g)=2NO(g)△H=+180kJ?mol-1;2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ?mol-1;则反应:2NO(g)+2CO2(g)?N2(g)+2CO2(g)的△H=
-760.3kJ?mol-1
-760.3kJ?mol-1
;(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2 (g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
| c2(N2O5) |
| c4( NO2)c(O2) |
| c2(N2O5) |
| c4( NO2)c(O2) |
放
放
热反应②反应达到平衡后,NO2的转化率为
49.6%
49.6%
,此时若再通入一定量氮气,则NO2的转化率将不变
不变
(填“增大”、“减小”、“不变”);③如图2中表示N2O5 的浓度的变化曲线是
c
c
,用O2表示从0~500s内该反应的平均速率v=1.51×10-3mol/(L?s)
1.51×10-3mol/(L?s)
.分析:(1)根据能量变化图,反应热等于正反应的活化能减去逆反应的活化能;据盖斯定律,利用后三个化学方程式就可以求出反应的焓变;
(2)①根据平衡常数表达式的书写来解答;根据升高温度平衡常数减小,说明升高温度平衡向逆反应方向移动,再根据温度对化学平衡的影响;
②根据表格可知1000S时反应达到平衡,根据转化率的公式求解;根据再通入一定量氮气,没有引起体系中4NO2(g)+O2 (g)?2N2O5(g)各物质浓度的变化;
③根据反应物的浓度在减少,生成物的浓度再增加,以及利用系数之比等于化学反应速率之比来求解;根据化学反应速率V=
=
利用表格数据来求NO2的速率,然后利用系数之比等于化学反应速率之比来求O2的速率.
(2)①根据平衡常数表达式的书写来解答;根据升高温度平衡常数减小,说明升高温度平衡向逆反应方向移动,再根据温度对化学平衡的影响;
②根据表格可知1000S时反应达到平衡,根据转化率的公式求解;根据再通入一定量氮气,没有引起体系中4NO2(g)+O2 (g)?2N2O5(g)各物质浓度的变化;
③根据反应物的浓度在减少,生成物的浓度再增加,以及利用系数之比等于化学反应速率之比来求解;根据化学反应速率V=
| △C |
| △t |
| ||
| △t |
解答:解:(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1,
N2(g)+O2(g)=2NO(g)△H1=+180kJ?mol-1 ①
2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ?mol-1 ②
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1 ③
根据盖斯定律,②+③×2-①,得化学方程式为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=(-112.3kJ?mol-1 )+(-234kJ?mol-1)×2-(+180kJ?mol-1)=-760.3kJ?mol-1,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;-760.3kJ?mol-1;
(2)①化学平衡常数等于生成物的浓度系数次方之积除以反应物的浓度系数次方之积,所以K=
;升高温度平衡常数减小,说明升高温度平衡向逆反应方向移动,而升高温度平衡向吸热的方向移动,所以逆反应吸热,则正反应放热,故答案为:
;放;
②根据表格可知1000S时反应达到平衡,已反应的NO2为:20mol-10.08mol=9.92mol,NO2的转化率为
×100%=49.6%;再通入一定量氮气,没有引起体系中4NO2(g)+O2 (g)?2N2O5(g)各物质浓度的变化,所以平衡不移动,转化率不变,故答案为:49.6%;不变;
③因反应物的浓度在减少,生成物的浓度再增加,根据方程式可知O2是NO2的反应速率的
,N2O5和NO2的反应速率的
,则a为NO2的变化曲线;c为N2O5的变化曲线,d为氧气的变化曲线,
0~500s内反应的平均速率v(NO2)=
=6.04×10-3mol/(L?s),
v(O2)=v(NO2)×
=1.51×10-3mol/(L?s),
故答案为:c;1.51×10-3mol/(L?s).
N2(g)+O2(g)=2NO(g)△H1=+180kJ?mol-1 ①
2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ?mol-1 ②
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1 ③
根据盖斯定律,②+③×2-①,得化学方程式为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=(-112.3kJ?mol-1 )+(-234kJ?mol-1)×2-(+180kJ?mol-1)=-760.3kJ?mol-1,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;-760.3kJ?mol-1;
(2)①化学平衡常数等于生成物的浓度系数次方之积除以反应物的浓度系数次方之积,所以K=
| c2(N2O5) |
| c4( NO2)c(O2) |
| c2(N2O5) |
| c4( NO2)c(O2) |
②根据表格可知1000S时反应达到平衡,已反应的NO2为:20mol-10.08mol=9.92mol,NO2的转化率为
| 9.92mol |
| 20mol |
③因反应物的浓度在减少,生成物的浓度再增加,根据方程式可知O2是NO2的反应速率的
| 1 |
| 4 |
| 1 |
| 2 |
0~500s内反应的平均速率v(NO2)=
| ||
| 500s |
v(O2)=v(NO2)×
| 1 |
| 4 |
故答案为:c;1.51×10-3mol/(L?s).
点评:本题考查了热化学方程式、化学平衡常数、化学平衡移动、化学反应速率的计算等,题目较为综合,难度中等,注意做题方法、判断规律的积累.

练习册系列答案
相关题目
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.