题目内容
【题目】研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体( Na2MoO4·2H2O)的途径如图所示:
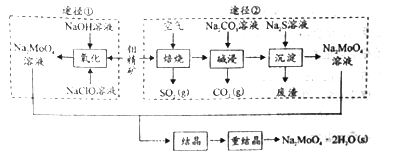
回答下列问题:
Ⅰ.(1)下列标志中,应贴在保存NaClO容器上的是____________。

(2)为了提高焙烧效率,除增大空气量外还可以采用的措施有__________________。
(3)途径①制备钼酸钠溶液,同时有SO42-生成,该反应的离子方程式为_____________。
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是________________________。
(5)“结晶”前测得部分离子浓度c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L,需加入Ba(OH)2固体除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率为______%。(保留三位有效数字)。
Ⅱ.(1)碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____。
(2)若缓释剂钼酸钠-月桂酰肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为_________(保留三位有效数字)。[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaMoO4)=4.0×10-8,加入 Ba(OH)2固体引起溶液体积变化可忽略]。

【答案】 B 充分粉碎矿石 MOS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O 母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度 97.3% Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得碳钢在盐酸中的腐蚀速率明显快 7.28×10-4 mol·L-1
【解析】Ⅰ.(1)NaClO是强氧化剂,应在保存NaClO容器上贴上的标志是氧化剂,答案选B;(2)提高焙烧效率,除增大空气量外还可以采用的措施是充分粉碎矿石或逆流焙烧;(3)途径①制备钼酸钠溶液,用NaClO在碱性条件下氧化MoO3,同时有SO42-生成,反应的离子方程式为MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;(4)母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度,故重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理;(5)BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=![]() =1×10-7mol/L,溶液中硫酸根离子的浓度为:c(SO42-)=
=1×10-7mol/L,溶液中硫酸根离子的浓度为:c(SO42-)=![]() mol/L=1.1×10-3mol/L,硫酸根离子的去除率为:1-
mol/L=1.1×10-3mol/L,硫酸根离子的去除率为:1-![]() ×100%=1-2.75%≈97.3%;
×100%=1-2.75%≈97.3%;
Ⅱ.(1)由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢,即答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;(2)根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,所以钼酸钠的浓度为:150mgL-1,1L溶液中含有的钼酸钠物质的量为:![]() ≈7.28×10-4mol,所以钼酸钠溶液的物质的量浓度为:7.28×l0-4molL-1。
≈7.28×10-4mol,所以钼酸钠溶液的物质的量浓度为:7.28×l0-4molL-1。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案




