题目内容
【题目】【化学—选修3:物质结构与性质】
Cu、Ni、V为制造合金及合成催化剂的重要元素。
请回答:
(1)Cu元素位于元素周期表的_________区,其基态原子有_________种能量不同的电子。
(2)[Cu(NH3)4]SO4是一种重要的配合物。与SO42-互为等电子体的分子的化学式为__________(任写一种);NH3分子的VSEPR模型为_______________。
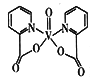
(3)Ni(CO)4的熔点为-25℃,沸点为43℃。其晶体类型为___________。晶体中σ键和π键的数目之比为_________。
(4)Ni可作为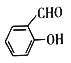 或
或![]() 与H2加成的催化剂。在相同压强下,
与H2加成的催化剂。在相同压强下, 的沸点比
的沸点比![]() 低,原因为_________________。
低,原因为_________________。
(5)  有增强胰岛素和降糖作用,其中所含非金属元素的电负性由小到大的顺序为______(用元素符号表示);氧原子的杂化轨道类型为______________。
有增强胰岛素和降糖作用,其中所含非金属元素的电负性由小到大的顺序为______(用元素符号表示);氧原子的杂化轨道类型为______________。
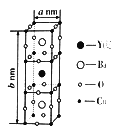
(6)已知:钇钡铜氧晶体的晶胞是一个长方体(如图所示),其晶胞参数分別为a nm、bnm,阿伏加德罗常数的值为NA。则该晶体的密度为________g /cm3(列出计算式即可)。
【答案】 ds 7 CCl4、SiCl4、CBr4、SiF4等合理答案即可 四面体形 分子晶体 1:1  形成分子内氢键,而
形成分子内氢键,而![]() 形成分子间氢键 H<C<N<O sp3
形成分子间氢键 H<C<N<O sp3 ![]()
【解析】(1)区的名称来自于按照工作原理最后填入电子轨道的名称,因此Cu元素位于元素周期表的ds区,其基态原子的电子排布式为1s22s22p63s23p63d104s1,因此有7种能量不同的电子。(2)原子数和价电子数分别都相等的是等电子体,则与SO42-互为等电子体的分子的化学式为CCl4、SiCl4、CBr4、SiF4等;NH3分子中氮原子的价层电子对数=3+(5-3×1)/2=4,所以VSEPR模型为四面体形。(3)Ni(CO)4的熔点为-25℃,沸点为43℃,这说明晶体类型为分子晶体。单键都是σ键,双键中含有1个σ键和1个π键,三键中含有1个σ键和2个π键,晶体中σ键和π键的数目之比为8:8= 1:1。(4)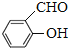 形成分子内氢键,而
形成分子内氢键,而![]() 形成分子间氢键,分子间氢键大于分子内氢键,因此在相同压强下,
形成分子间氢键,分子间氢键大于分子内氢键,因此在相同压强下, 的沸点比
的沸点比![]() 低。(5) 非金属性越强,电负性越大,则其中所含非金属元素的电负性由小到大的顺序为H<C<N<O;氧原子的价层电子对数是4,杂化轨道类型为sp3。(6)Y位于体心,数目为1,Ba位于体心,数目为2,Cu位于顶点和棱心,数目为8×1/8+8×1/4=3,O位于棱心和面心,数目为12×1/4+8×1/2=7,化学式为YBa2Cu3O7,则该晶体的密度为
低。(5) 非金属性越强,电负性越大,则其中所含非金属元素的电负性由小到大的顺序为H<C<N<O;氧原子的价层电子对数是4,杂化轨道类型为sp3。(6)Y位于体心,数目为1,Ba位于体心,数目为2,Cu位于顶点和棱心,数目为8×1/8+8×1/4=3,O位于棱心和面心,数目为12×1/4+8×1/2=7,化学式为YBa2Cu3O7,则该晶体的密度为![]() 。
。