题目内容
(多选)由5mol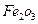 、4mol
、4mol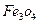 和3mol Fe0组成的混合物,加入纯铁1mol并在高温下和
和3mol Fe0组成的混合物,加入纯铁1mol并在高温下和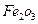 反应。若纯铁完全反应,则反应后混合物中Fe0与
反应。若纯铁完全反应,则反应后混合物中Fe0与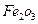 的物质的量之比可能是
的物质的量之比可能是
A 4:3 R.3:2 C,3:1 D.2:l
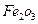 、4mol
、4mol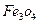 和3mol Fe0组成的混合物,加入纯铁1mol并在高温下和
和3mol Fe0组成的混合物,加入纯铁1mol并在高温下和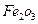 反应。若纯铁完全反应,则反应后混合物中Fe0与
反应。若纯铁完全反应,则反应后混合物中Fe0与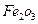 的物质的量之比可能是
的物质的量之比可能是A 4:3 R.3:2 C,3:1 D.2:l
BC
略

练习册系列答案
相关题目
题目内容
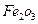 、4mol
、4mol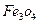 和3mol Fe0组成的混合物,加入纯铁1mol并在高温下和
和3mol Fe0组成的混合物,加入纯铁1mol并在高温下和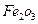 反应。若纯铁完全反应,则反应后混合物中Fe0与
反应。若纯铁完全反应,则反应后混合物中Fe0与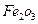 的物质的量之比可能是
的物质的量之比可能是