题目内容
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag。下列有关说法正确的是

A.2molCu与1 molAg2O的总能量低于1 molCu2O与2molAg具有的总能量
B.负极的电极反应式为2Cu+2OH--2e-=Cu2O+H2O
C.测量原理示意图中,电流方向从Cu流向Ag2O
D.电池工作时,OH-向Ag电极移动
【答案】B
【解析】
由电池反应方程式2Cu+Ag2O=Cu2O+2Ag知,较活泼的金属铜失电子发生氧化反应,所以铜作负极,较不活泼的金属银作正极,原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动;根据原电池的构成条件之一为自发的放热的氧化还原反应分析反应物与生成物的总能量大小。
A. 因为原电池的构成条件之一为自发的放热的氧化还原反应,所以该反应为放热反应,则2molCu与1 molAg2O的总能量高于1 molCu2O与2molAg具有的总能量,A项错误;
B. 负极发生失电子的氧化反应,电极反应为2Cu+2OH--2e-=Cu2O+H2O,B项正确;
C. 测量原理示意图中,电流方向从正极流向负极,即从Ag2O流向Cu,C项错误;
D. 原电池工作时,阴离子向负极移动,阳离子向正极移动,即OH-向Cu电极移动,D项错误;
答案选B。

【题目】实验小组同学对乙醛与新制的Cu(OH)2反应的实验进行探究。
实验Ⅰ:取2mL 10%的氢氧化钠溶液于试管中,加入5滴2%的CuSO4溶液和5滴5%的乙醛溶液,加热时蓝色悬浊液变黑,静置后未发现红色沉淀。
实验小组对影响实验Ⅰ成败的因素进行探究:
(1)探究乙醛溶液浓度对该反应的影响。
编号 | 实验Ⅱ | 实验Ⅲ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变红棕色,静置后底部有大量红色沉淀 | 加热,蓝色悬浊液变红棕色,静置后上层为棕黄色油状液体,底部有少量红色沉淀 |
已知:乙醛在碱性条件下发生缩合反应:CH3CHO+CH3CHO![]() CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
① 能证明乙醛被新制的Cu(OH)2 氧化的实验现象是______。
② 乙醛与新制的Cu(OH)2 发生反应的化学方程式是______。
③ 分析实验Ⅲ产生的红色沉淀少于实验Ⅱ的可能原因:______。
(2)探究NaOH溶液浓度对该反应的影响。
编号 | 实验Ⅳ | 实验Ⅴ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,蓝色悬浊液变红棕色, 静置后底部有红色沉淀 |
依据实验Ⅰ→Ⅴ,得出如下结论:
ⅰ. NaOH溶液浓度一定时,适当增大乙醛溶液浓度有利于生成Cu2O。
ⅱ. 乙醛溶液浓度一定时,______。
(3)探究NaOH溶液浓度与乙醛溶液浓度对该反应影响程度的差异。
编号 | 实验Ⅵ | 实验Ⅶ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,静置后底部有红色沉淀 |
由以上实验得出推论: ______。
【题目】下列实验操作及现象能够达成相应实验结论的是( )
选项 | 实验操作及现象 | 结论 |
A | 向某溶液中加入BaCl2溶液,有白色沉淀生成 | 溶液中一定含有 |
B | 向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色气体 | 溶液中一定含有 |
C | 向某溶液中先加入盐酸酸化,没有明显现象,再加入BaCl2溶液,有白色沉淀产生 | 溶液中一定含有SO42- |
D | 向5mL饱和氯水中滴加少量0.1 mol/L NaBr溶液,溶液由无色变为橙黄色,再滴加足量0.1 mol/L淀粉-KI溶液,溶液变蓝 | 氧化性强弱:Cl2>Br2>I2 |
A.AB.BC.CD.D
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
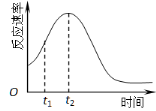 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。
【题目】我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(主要成份是ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c(Mn+)=0.10mol·L–1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.3 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)写出ZnS的电子式__________________________;
焙烧过程中主要反应的化学方程式为__________________________。
(2)滤渣1的成分为:___________________;
(3)试剂Y是_________(只要求填写一种), 调PH值的范围是___________________。
(4)电解硫酸锌溶液制备单质锌时,电解的总反应离子方程式为:___________________。
(5)为将溶液中的Fe2+氧化,试剂X可选用的是_______。(填序号)
A.H2O2 B.H2S C.HNO3 D.O2








