题目内容
5.已知1~18号元素的离子cY2-、bX+、aW2+、dZ-都具有相同的电子层结构,下列关系正确的是( )| A. | 质子数:c>d | B. | 原子半径:X<W | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 离子的还原性:Y2->Z- |
分析 元素周期表前三周期元素的离cY2-、bX+、aW2+、dZ-具有相同电子层结构,核外电子数相等,所以a-2=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Mg元素,X为Na元素,结合元素周期律解答.
解答 解:元素周期表前三周期元素的离子aW2+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-2=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Mg元素,X为Na元素,
A.由以上分析可知c=8,b=11,则质子数c<b,故A错误;
B.W为Mg元素,X为Na元素,同周期随原子序数增大原子半径减小,故原子半径Na>Mg,故B错误;
C.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为H2O<HF,故C错误;
D.非金属性F>O,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,则离子还原性O2->F-,故D正确.
故选D.
点评 本题考查原子结构与元素周期律的相关知识,难度不大,可以根据电子层结构确定在周期表中的位置关系,从而推断其性质,不需确定具体的元素.

练习册系列答案
相关题目
14.下列有关物质的性质及其对应的应用均正确的是( )
| A. | Al是不活泼的金属,故铝可制成铝箔包装物品 | |
| B. | NaHCO3能与碱反应,故NaHCO3可以用于制作糕点 | |
| C. | NH3能与Cl2生成NH4Cl,故可用浓氨水检验输送氯气的管道是否有泄漏 | |
| D. | 明矾与K2FeO4都能与水生成胶体,均可用于水的净化、杀菌和消毒 |
16.下列各组性质的比较中正确的是( )
| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:HCl<H2S<PH3 | D. | 还原性:Cl->Br->I- |
13.将SO2气体分别通入下列试剂,现象和结论均正确的是( )
| 选项 | 试剂 | 现象 | 结论 |
| A | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
| B | FeCl3溶液 | 溶液褪至浅绿色 | SO2有还原性 |
| C | 滴有酚酞的NaOH溶液 | 无明显变化 | SO2与NaOH溶液不反应 |
| D | 紫色石蕊试液 | 溶液变红后褪色 | SO2水溶液有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
20.下列物质中不能发生消去反应的是( )
| A. | 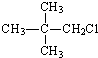 | B. | 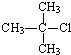 | C. |  | D. | 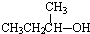 |
10.现有部分元素的性质与原子(或分子)结构如表:
(1)写出元素T的原子结构示意图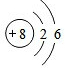 .
.
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式: .
.
(4)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:N2H4+2H2O2═N2↑+4H2O.
(5)T、W(+4价)、Y形成的正盐溶液中含有溶质0.20mol,另一溶液是200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是B
A.2.0mol/L B.1.5mol/L C.0.18mol/L D.0.24mol/L.
| 元素编号 | 元素性质与原子(或分子)结构 | |
| T | 最外层电子数是次外层电子数的3倍 | |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 | |
| Y | M层比K层少1个电子 | |
| Z | 第三周期元素的简单离子中半径最小 | |
| W | W带两个负电荷的阴离子与Ar具有相同电子层结构 | |
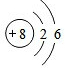 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:
 .
.(4)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:N2H4+2H2O2═N2↑+4H2O.
(5)T、W(+4价)、Y形成的正盐溶液中含有溶质0.20mol,另一溶液是200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是B
A.2.0mol/L B.1.5mol/L C.0.18mol/L D.0.24mol/L.
14.下列说法正确的是( )
| A. | 1 mol阿司匹林( )与足量的NaOH溶液反应,消耗NaOH最大的物质的量为2mol )与足量的NaOH溶液反应,消耗NaOH最大的物质的量为2mol | |
| B. | 汽油、柴油等矿物油与植物油主要成分都是烃,均可以萃取溴水中的溴 | |
| C. | 丙氨酸和苯丙氨酸脱水,最多可生成4种二肽 | |
| D. | 苯酚能与溴水反应,苯不能与溴水反应,说明苯环对羟基有影响 |
15.关于原电池的下列说法中,正确的是( )
| A. | 在正极上发生还原反应 | B. | 化学性质较活泼的金属为正极 | ||
| C. | 在外电路,电子流出正极 | D. | 是由电能转化为化学能的装置 |

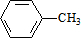 ,C的名称:苯甲醇
,C的名称:苯甲醇 +HCl,取代反应
+HCl,取代反应 ,取代反应
,取代反应  .
.