题目内容
(1)写出下列物质的电离方程式
A、NaHCO3-
(2)写出下列物质的水解方程式
A、CH3COONa
(3)写出下列难溶电解质的溶解方程式
A、Al(OH)3
(4)、写出下列物质反应的热化学方程式
A、0.4mol(N2H4)液态肼与足量的液态双氧水反应,生成氮气和水蒸气,并放出256.65kJ的热量
B、氢气的燃烧热是285.8kJ/mol;
A、NaHCO3-
NaHCO3=Na++HCO3-
NaHCO3=Na++HCO3-
;B、CH3COOH-CH3COOH?CH3COO-+H+
CH3COOH?CH3COO-+H+
.(2)写出下列物质的水解方程式
A、CH3COONa
CH3COONa+H2O?CH3COOH+NaOH
CH3COONa+H2O?CH3COOH+NaOH
;B、Fe2(SO4)3Fe2(SO4)3+6H2O?2Fe(OH)3+3H2SO4
Fe2(SO4)3+6H2O?2Fe(OH)3+3H2SO4
.(3)写出下列难溶电解质的溶解方程式
A、Al(OH)3
Al(OH)3(S)?Al3+(aq)+3OH-(aq)
Al(OH)3(S)?Al3+(aq)+3OH-(aq)
;B、AgClAgCl(S)?Ag+(aq)+Cl-(aq)
AgCl(S)?Ag+(aq)+Cl-(aq)
.(4)、写出下列物质反应的热化学方程式
A、0.4mol(N2H4)液态肼与足量的液态双氧水反应,生成氮气和水蒸气,并放出256.65kJ的热量
N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1
N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1
;B、氢气的燃烧热是285.8kJ/mol;
H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol
| 1 |
| 2 |
H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol
.| 1 |
| 2 |
分析:(1)A、碳酸氢钠是弱酸强碱酸式盐,是强电解质完全电离;
B、乙酸为弱酸,部分电离;
(2)根据盐的水解实质:盐中的弱离子和水电离出的氢离子或是氢氧根离子结合生成弱电解质的过程来书写;(3)在一定温度下,当沉淀溶解和生成的速率相等时,分别得到Al(OH)3、AgCl的饱和溶液,就到达溶解平衡据此书写;
(4)A、计算1mol液态肼与足量液态双氧水反应时放出的热量,可写出反应的热化学方程式;
B、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物,以此解答.
B、乙酸为弱酸,部分电离;
(2)根据盐的水解实质:盐中的弱离子和水电离出的氢离子或是氢氧根离子结合生成弱电解质的过程来书写;(3)在一定温度下,当沉淀溶解和生成的速率相等时,分别得到Al(OH)3、AgCl的饱和溶液,就到达溶解平衡据此书写;
(4)A、计算1mol液态肼与足量液态双氧水反应时放出的热量,可写出反应的热化学方程式;
B、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物,以此解答.
解答:解:(1)A、碳酸氢钠是弱酸强碱酸式盐,是强电解质完全电离;电离方程式为:NaHCO3=Na++HCO3-;
B、乙酸为弱酸,部分电离,电离方程式为:CH3COOH?CH3COO-+H+,
故答案为:NaHCO3=Na++HCO3-;CH3COOH?CH3COO-+H+;
(2)醋酸钠中含有弱离子醋酸根离子,可以和水电离出的氢离子结合生成醋酸,实质是:CH3COONa+H2O?CH3COOH+NaOH,Fe2(SO4)3溶液中,三价铁易水解为氢氧化铁,实质是:Fe2(SO4)3+6H2O?2Fe(OH)3+3H2SO4,
故答案为:CH3COONa+H2O?CH3COOH+NaOH;Fe2(SO4)3+6H2O?2Fe(OH)3+3H2SO4;
(3)氢氧化铝沉淀在水中电离出铝离子和氢氧根离子,溶解方程式为Al(OH)3(S)?Al3+(aq)+3OH-(aq);AgCl沉淀电离出银离子和氯离子,溶解方程式为:AgCl(S)?Ag+(aq)+Cl-(aq),
故答案为:Al(OH)3(S)?Al3+(aq)+3OH-(aq);AgCl(S)?Ag+(aq)+Cl-(aq);
(4)A、0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1;
B、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,氢气的燃烧热是285.8kJ/mol,所以热化学方程式为:H2(g)+
O2(g)=H2O(l)△H=-285.8 kJ/mol,
故答案为:H2(g)+
O2(g)=H2O(l)△H=-285.8 kJ/mol.
B、乙酸为弱酸,部分电离,电离方程式为:CH3COOH?CH3COO-+H+,
故答案为:NaHCO3=Na++HCO3-;CH3COOH?CH3COO-+H+;
(2)醋酸钠中含有弱离子醋酸根离子,可以和水电离出的氢离子结合生成醋酸,实质是:CH3COONa+H2O?CH3COOH+NaOH,Fe2(SO4)3溶液中,三价铁易水解为氢氧化铁,实质是:Fe2(SO4)3+6H2O?2Fe(OH)3+3H2SO4,
故答案为:CH3COONa+H2O?CH3COOH+NaOH;Fe2(SO4)3+6H2O?2Fe(OH)3+3H2SO4;
(3)氢氧化铝沉淀在水中电离出铝离子和氢氧根离子,溶解方程式为Al(OH)3(S)?Al3+(aq)+3OH-(aq);AgCl沉淀电离出银离子和氯离子,溶解方程式为:AgCl(S)?Ag+(aq)+Cl-(aq),
故答案为:Al(OH)3(S)?Al3+(aq)+3OH-(aq);AgCl(S)?Ag+(aq)+Cl-(aq);
(4)A、0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1;
B、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,氢气的燃烧热是285.8kJ/mol,所以热化学方程式为:H2(g)+
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
点评:本题考查了电离方程式、水解方程式、溶解方程式、热化学方程式的书写,注意书写方法是解答本题的关键,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目


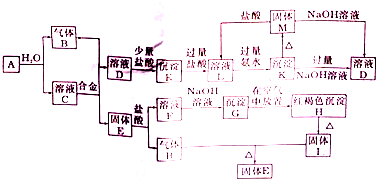
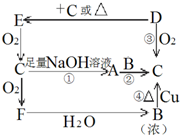 如图是六种物质的相互转化关系.已知E是固态单质,常见于火山口处,六种物质中均含有构成E的元素.
如图是六种物质的相互转化关系.已知E是固态单质,常见于火山口处,六种物质中均含有构成E的元素.