题目内容
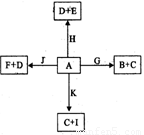
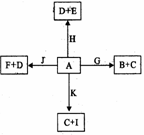
已知A~K均为中学化学中常见的物质,它们之间有如下图所示的转化关系,其中A为两种物质组成的混合物,H、I、K为单质,H是气体,G是红褐色沉淀.(反应过程中生成的水及其他产物没有列出)

请回答以下问题:
(1)写出下列物质的化学式:H
(2)写出A跟盐酸混合反应生成B的化学方程式:
(3)写出C跟氯气反应生成E的化学方程式:

请回答以下问题:
(1)写出下列物质的化学式:H
H2
H2
,JFe2O3
Fe2O3
.(2)写出A跟盐酸混合反应生成B的化学方程式:
CuO+2HCl=CuCl2+H2O
CuO+2HCl=CuCl2+H2O
.(3)写出C跟氯气反应生成E的化学方程式:
2FeCl2+Cl2=2FeCl3
2FeCl2+Cl2=2FeCl3
.分析:红褐色沉淀G是Fe(OH)3沉淀,所以C为FeCl2,E为FeCl3,J为Fe2O3,H是单质气体,能与Fe2O3在加热条件下反应生成的单质K显然是Fe,H应为H2,I为单质,且呈紫红色,I应为铜,黑色粉末F为CuO,D为Cu(OH)2,B为CuCl2,原黑色粉末应为CuO和铁粉的混合物,结合对应物质的性质和题目要求解答该题.
解答:解:红褐色沉淀G是Fe(OH)3沉淀,所以C为FeCl2,E为FeCl3,J为Fe2O3,H是单质气体,能与Fe2O3在加热条件下反应生成的单质K显然是Fe,H应为H2,I为单质,且呈紫红色,I应为铜,黑色粉末F为CuO,D为Cu(OH)2,B为CuCl2,原黑色粉末应为CuO和铁粉的混合物,
(1)由以上分析可知H为H2,J为Fe2O3,故答案为:H2;Fe2O3;
(2)黑色粉末应为CuO和铁粉的混合物,CuO可与盐酸反应,反应的化学方程式为CuO+2HCl=CuCl2+H2O,
故答案为:CuO+2HCl=CuCl2+H2O;
(3)C为FeCl2,具有还原性,可与氯气发生氧化还原反应,反应的化学方程式为2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3.
(1)由以上分析可知H为H2,J为Fe2O3,故答案为:H2;Fe2O3;
(2)黑色粉末应为CuO和铁粉的混合物,CuO可与盐酸反应,反应的化学方程式为CuO+2HCl=CuCl2+H2O,
故答案为:CuO+2HCl=CuCl2+H2O;
(3)C为FeCl2,具有还原性,可与氯气发生氧化还原反应,反应的化学方程式为2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3.
点评:本题考查无机物的推断,侧重于物质的性质的考查,注意把握该题的突破口,根据物质的特征颜色作为解答的突破口.

练习册系列答案
相关题目
 有效数字)。
有效数字)。