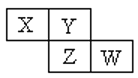
题目内容
【题目】如图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d 为两个电极。下列有关的判断不正确的

A. c 为负极,发生氧化反应
B. 电池工作的过程中,d 电极上产生气泡
C. 电池工作时,溶液中 SO42-向 d 移动
D. 电池工作的过程中,溶液中 SO42-浓度基本不变
【答案】C
【解析】
根据电流方向,c为负极,d为正极。在原电池中,一般活泼金属作负极,c为Zn,失去电子生成Zn2+,d为铜,H+在铜电极上得到电子生成H2;
A.根据电流方向,c为电流流入的一极,为负极,负极失去电子,发生氧化反应,故A正确;
B.工作过程中,D为正极,2H++2e-=H2↑,有氢气生成,产生气泡,故B正确;
C.在原电池中阴离子向负极移动,SO42-应该向c极移动,故C错误;
D.电池的总反应方程式为Zn+2H+=Zn2++H2↑,SO42-没有参与反应,浓度基本不变,故D正确;
故答案为C。

 提分百分百检测卷单元期末测试卷系列答案
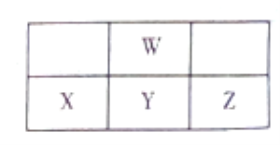
提分百分百检测卷单元期末测试卷系列答案【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
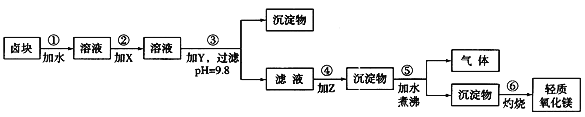
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6﹡ |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去
表2 原料价格表
物质 | 价格/(元·吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
(1)在步骤②中加入的试剂X,最佳的选择是____________,其作用是_________________;
(2)在步骤③中加入的试剂应是_______________________;之所以要控制pH=9.8,其目的是___________________________________________________________。
(3)在步骤④中加入的试剂Z应是________________;/p>
(4)在步骤⑤中发生反应的化学方程式是_____________________________________________。