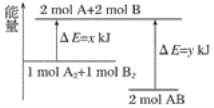
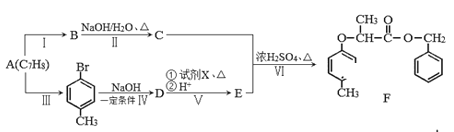
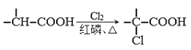
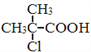��Ŀ����
����Ŀ��ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̡�
I����ˮ����ͨ�����ȵ�̿���ɲ���ˮú������ӦΪ��C(s)��H2O(g)![]() CO(g)��H2(g)
CO(g)��H2(g)
��1����ʹ��ѧ��Ӧ���ʼӿ�Ĵ�ʩ��________(�����)��
�����߷�Ӧ�¶�������C�����ʵ������ܱն��������г���CO(g)
II����ҵ����CO����ȼ�ϼ״���һ�������·�����ӦCO��g��+2H2��g��![]() CH3OH��g����
CH3OH��g����
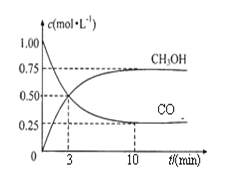
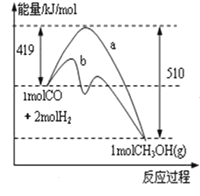
ͼ1 ͼ2
��2��ͼ1�DZ�ʾһ���¶��£������Ϊ2L���ܱ������м���4molH2��һ������CO��CO��CH3OH��g����Ũ����ʱ��仯������ӷ�Ӧ��ʼ��ƽ�⣬��H2Ũ�ȱ仯��ʾƽ����Ӧ����v��H2��=__________________��
��3��ͼ2��ʾ�÷�Ӧ���й����������ı仯������a��ʾ��ʹ�ô���ʱ��Ӧ�������仯������b��ʾʹ�ô�����������仯������ͼ����ʹ����ӿ컯ѧ��Ӧ���ʵ�ԭ��_______________________________���÷�Ӧ����1molCOʱ��______�������ų���������������__________KJ������
���𰸡��٢� 0.15molL��1min��1 �����뷴Ӧ������γ��м�̬�������˷�Ӧ��� �ų� 91
��������
��1����Ӱ�췴Ӧ���ʵ����ط�����
��2������v=��c/��t���м��㣻
��3�������ӿ컯ѧ��Ӧ���ʵ�ԭ���Ǵ����뷴Ӧ������γ��м�̬�������˷�Ӧ��ܣ����÷�Ӧǰ�����������������Ӧ�������仯��
��1��C(s)��H2O(g)![]() CO(g)��H2(g)
CO(g)��H2(g)
�����߷�Ӧ�¶ȣ����������Ӱٷ�������Ӧ�������ʢ���ȷ��
��CΪ���壬����C�����ʵ�������Ӧ���Ũ�Ȳ��䣬��Ӧ���ʲ��䣬�ʢڴ���
���ܱն��������г���CO(g)������Ũ����������Ӧ��Ũ�ȣ���Ӧ�������ʢ���ȷ��
�ʴ�Ϊ���٢ۡ�
��2����ͼ1��֪��COŨ�ȱ仯��Ϊ1.00mol/L-0.25mol/L=0.75mol/L����t=10min����v��CO��=0.75mol/L��10min=0.075mol/��L��min��������CO��g��+2H2��g��![]() CH3OH��g������ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ���v��H2��=2v��CO��=2��0.075mol/��L��min��=0.15 mol/��L��min�����ʴ�Ϊ��0.15 mol/��L��min����
CH3OH��g������ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ���v��H2��=2v��CO��=2��0.075mol/��L��min��=0.15 mol/��L��min�����ʴ�Ϊ��0.15 mol/��L��min����
��3�������ӿ컯ѧ��Ӧ���ʵ�ԭ���Ǵ����뷴Ӧ������γ��м�̬�������˷�Ӧ��ܣ���ͼ2��֪���÷�Ӧ�з�Ӧ�����������������������������ʸ÷�ӦΪ���ȷ�Ӧ����Ӧ��Ϊ1molCO��g����2molH2��g����������Ϊ1molCH3OH��g������H=419kJ/mol-510kJ/mol=-91kJ/mol�����Ե���Ӧ����1molCOʱ���ų�91kJ���������ʴ�Ϊ�������뷴Ӧ������γ��м�̬�������˷�Ӧ��ܣ��ų���91��