题目内容
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式: 。
(2)PO43—的空间构型是 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。N2H4分子中氮原子轨道的杂化类型是 。
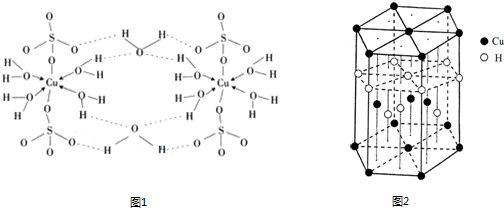
(4)胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有 。(填序号)
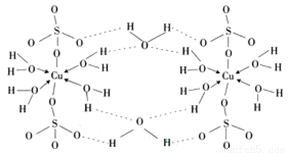
a.离子键 b.极性键 c.金属键
d.配位键 e.氢键 f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键的数目为 。
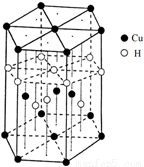
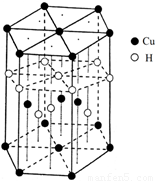
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为 。
(1)[Ar]3d9 (2)正四面体 (3)sp3 (4)abde
(5)2NA或2mol (6)CuH
【解析】
试题分析: (1)Cu原子序数为29,核外电子排布式为[Ar]3d104s1,Cu2+电子排布式为[Ar]3d9。(2)PO43—中P价层电子对数=(5+0×4+3)/2=4,P与4个O形成4个键,离子空间构型为正四面体。(3)N2H4分子中N形成3个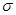 键还有1对孤对电子,N杂化类型为sp3。(4)CuSO4·5H2O组成为[Cu(H2O)4]SO4·H2O,[Cu(H2O)4]2+与SO42-以离子键结合,Cu2+与H2O以配位键结合,H和O以极性共价键结合,结晶水中的H和O分别和O和H形成氢键。(5)CN-中C和N形成三键,三键中有1个
键还有1对孤对电子,N杂化类型为sp3。(4)CuSO4·5H2O组成为[Cu(H2O)4]SO4·H2O,[Cu(H2O)4]2+与SO42-以离子键结合,Cu2+与H2O以配位键结合,H和O以极性共价键结合,结晶水中的H和O分别和O和H形成氢键。(5)CN-中C和N形成三键,三键中有1个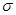 键和2个
键和2个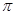 键。(6)晶胞中Cu个数为1/6×12+1/2×2+3=6、H个数为1/3×6+4=6。
键。(6)晶胞中Cu个数为1/6×12+1/2×2+3=6、H个数为1/3×6+4=6。
考点: 电子排布式 离子空间构型 中心原子杂化类型 化学键 氢键 配位化合物 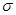 键、
键、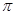 键 晶胞计算
键 晶胞计算