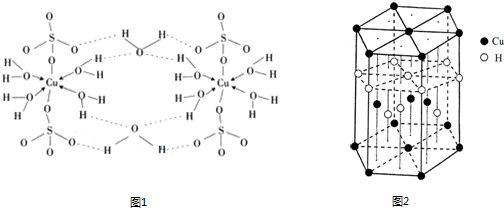
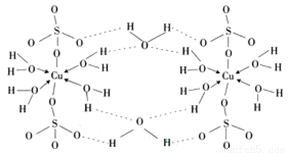
题目内容
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式: 。与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有 (填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为 。
(2)PO43-的空间构型是 。
(3)与NH3互为等电子体的分子、离子有 、 (各举一例)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为 。
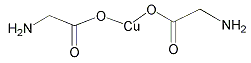
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键的数目为 。
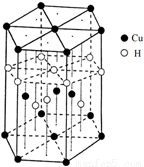
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为 。
(7)铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度 。
(1)[Ar]3d9;K Cr; O<N(2)正四面体 (3)PH3 或AsH3 。H3O+或CH3- 。 (4)sp3 sp2
(5)2NA (6)CuH (7)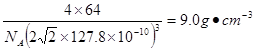
【解析】
试题分析:(1)Cu是29号元素,其基态Cu2+的核外电子排布式为:[Ar]3d9。与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K
Cr。7号元素N原子的电子排布式为1s22s22p3.
8号元素O原子的电子排布式为1s22s22p4.当元素的原子核外电子层上的电子处于全充满、半充满或全空状态时,能量低比较稳定。N原子的电子处于半充满状态,是稳定状态。所以N、O元素第一电离能由小到大的顺序为O<N。(2)PO43-的空间构型是正四面体。(3)与NH3互为等电子体的分子有CH4、H2O、HF、PH3 或AsH3;离子有NH4+、H3O+、OH-、CH3-等。(4)在氨基乙酸铜的分子中-CH2-碳原子为sp3 杂化,羰基碳原子为sp2杂化。在CN-中碳原子与氮原子是以共价三键结合的,含有的2个π键。所以1 mol CN-中含有的π键的数2NA
。(6)在该化合物的晶胞中Cu:12×(1/6)+2×(1/2)+3=6;H:6×(1/3)+1+3=6所以Cu:H=1:1.故该化合物的化学式为 CuH。(7)铜晶体为面心立方最密堆积,则每个晶胞中含有铜的原子:8 ×(1/8)+6×(1/2)=4.Cu原子半径为127.8pm=1.278×10-10cm,假设晶体铜的密度为p,晶胞的边长为d.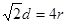 ,。
,。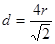 则晶胞的体积是d3,则p·d3=(4×64)/NA解得p=
则晶胞的体积是d3,则p·d3=(4×64)/NA解得p=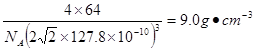 .
.
考点:考查有关Cu的原子结构、晶体结构、化学性质及密度的计算等知识。