题目内容
10.在一定条件下,反应2HI(g)?H2(g)+I2(g)(紫红色)△H>0,达到平衡时,要使混合气体的颜色加深,可采取的措施是( )①增大氢气的浓度
②升高温度
③降低温度
④缩小体积
⑤增大HI的浓度
⑥减小压强.
| A. | ①③⑥ | B. | ②④⑤ | C. | ③⑤⑥ | D. | ①③⑤ |
分析 要使混合气体的颜色加深,即增大了碘的浓度,平衡正向移动,从影响平衡移动的因素角度考虑.
解答 解:①增大氢气的浓度,平衡逆向移动,混合气体的颜色变浅,故错误;
②升高温度,平衡正向移动,混合气体的颜色加深,故正确;
③降低温度,平衡逆向移动,混合气体的颜色变浅,故错误;
④缩小体积,各种气体的浓度都增大,混合气体的颜色加深,故正确;
⑤增大HI浓度,平衡正向移动,碘浓度增大,混合气体的颜色加深,故正确;
⑥减小压强,各气体浓度减小,混合气体的颜色变浅,故错误;
故选B.
点评 本题考查了影响平衡移动的因素,注意影响平衡移动的因素有温度、浓度、压强三种,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.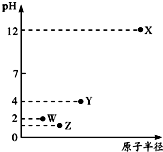 第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如图所示.下列说法正确的是( )
第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如图所示.下列说法正确的是( )
 第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如图所示.下列说法正确的是( )
第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如图所示.下列说法正确的是( )| A. | 简单离子半径:X>Y>Z>W | |
| B. | Y与W形成的化合物分子可能是非极性分子 | |
| C. | 基态原子的第一电离能:W>Z>Y>X | |
| D. | X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性 |
1.如图曲线 a 表示放热反应2X(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按 b 曲线进行,不可能采取的措施是( )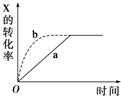

| A. | 恒温恒压时加催化剂 | B. | 恒温恒容时X的投入量增加 | ||
| C. | 恒压时升高温度 | D. | 恒温时减小容器体积 |
18.下列说法正确的是( )
| A. | 伴有能量变化的物质变化都是化学变化 | |
| B. | 凡是经过加热而发生的化学反应都是吸热反应 | |
| C. | 在一个确定的化学反应过程中,反应物的总能量总是高于生成物的总能量 | |
| D. | 化学反应中的能量变化主要是由化学键的断裂和形成引起的 |
15.在固定体积的密闭容器中加入4mol A和2mol B发生如下反应2A(g)+B(g)?3C(g)+D(g)达到平衡时C的浓度为m mol/L,若温度不变时按下列4种配比作为起始物质,达到平衡后C浓度仍为m mol/L的是( )
| A. | 2molA+1molB | B. | 2molA+1molB+3molC+1mol D | ||
| C. | 3molC+1molD | D. | 4molA+2molB+3molC |
2.足量下列物质与等质量的铝反应,放出氢气且消耗溶质物质的量最少的是( )
| A. | 氢氧化钠溶液 | B. | 稀硫酸 | C. | 稀盐酸 | D. | 稀硝酸 |
19.实验室中需配制 2mol•L-1的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
| A. | 1000 mL,111.2 g | B. | 950 mL,111.2 g | ||
| C. | 任意规格,117.0 g | D. | 1000 mL,117.0 g |
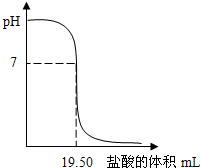 25℃时,用0.1000mol/LHCl滴定20.00mL未知浓度的NaOH溶液,得到如图所示的酸碱滴定曲线;根据曲线可查出pH=7时,所消耗的盐酸溶液体积为19.50mL.回答下列问题:
25℃时,用0.1000mol/LHCl滴定20.00mL未知浓度的NaOH溶液,得到如图所示的酸碱滴定曲线;根据曲线可查出pH=7时,所消耗的盐酸溶液体积为19.50mL.回答下列问题: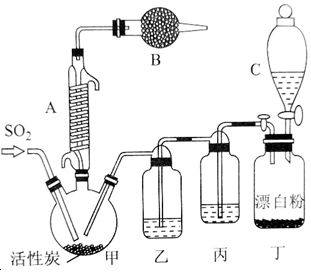 SO2(g)+Cl2(g)$\stackrel{活性炭}{?}$SO2Cl2(1)△H=-97.3kJ•mol-1 请回答下列问题:
SO2(g)+Cl2(g)$\stackrel{活性炭}{?}$SO2Cl2(1)△H=-97.3kJ•mol-1 请回答下列问题: