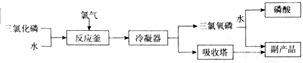
题目内容
4.等质量的固态硫分别在空气中和纯氧中完全燃烧,放出的热量( )| A. | 前者多 | B. | 后者多 | C. | 二者相等 | D. | 无法比较 |
分析 相同条件下(等质量,同温同压),这样的反应物和生成物之间的能量差应为定值,化学反应中的能量变化主要是以热能的形式表现出来,放出的热量应相同.
解答 解:硫无论在空气中还是在纯氧中燃烧都生成 SO2气体,而由于空气中氧气的浓度远不及在纯氧中,硫等可燃物在纯氧中的燃烧比在空气中的燃烧反应激烈,速率快,放热也集中.等质量的固态硫分别在空气中和纯氧中完全燃烧,这样的反应物和生成物之间的能量差为定值,化学反应中的能量变化主要是以热能的形式表现出来,但绝不是唯一的形式,化学反应发生时,常伴随有“发光、发热“等现象,硫在空气中燃烧“产生淡蓝色火焰”,在纯氧中燃烧发出“明亮的蓝紫色火焰”,显然,无论是在什么情况下燃烧,都有一部分化学能转化成为光能,而且转化成光能的越多,转变成热能的就越少,后者转化成光能的多,所以转化为热能就少,所以前者放出的热量多.
故选A.
点评 本题考查反应热与焓变等问题,侧重于基础知识的考查,难度不大,注意把握反应热的定义.

练习册系列答案
相关题目
14.设m为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 14gC2H4中含有2m个C-H键 | |
| B. | 1mol.L-1 NH3•H2O溶液中含有nA个NH4+ | |
| C. | 1molNa2O2和足量CO2反应产生nA个O2分子 | |
| D. | 常温常压下,22.4L的SO2中含有nA个SO2分子 |
19.下列叙述能证明金属A的金属性比金属B强的是( )
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子的电子层数比B原子的电子层数少 | |
| C. | 1mol A从稀硫酸中置换的氢气比1mol B置换的氢气多 | |
| D. | 常温下,A能从冷水中置换出氢气,而B不能 |
9.下列烷烃的系统名称中,不正确的是( )
| A. | 2,3-二甲基丁烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 2-甲基-3-乙基戊烷 | D. | 2,2,3-三甲基丁烷 |
14.如图是某条件时N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )
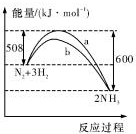

| A. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92kJ.mol-1 | |
| B. | 生成物的能量之和比反应物的能量之和高 92 kJ | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 加入催化剂可增加正反应速率,减小逆反应速率 |
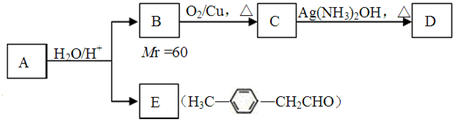
 .
. 、、
、、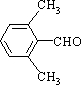 或
或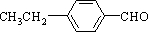 .
.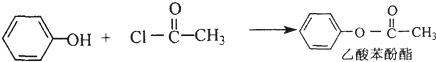 +HCl
+HCl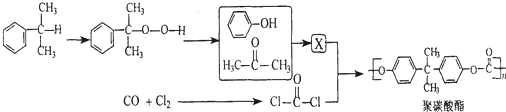
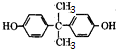 .
.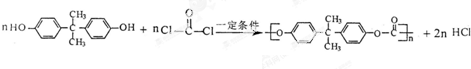 .
.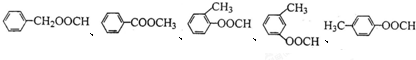 .
.