��Ŀ����
ij��Һ�п��ܺ���OH����CO32����AlO2����SiO32����SO42����HCO3����Na+��Fe3+��Mg2+��
Al3+ �����ӡ��������Һ����μ���һ�����ʵ���Ũ�ȵ�������Һʱ���������ɳ��������ʵ�����������Һ������仯��ͼ������ͼ��ʾ������˵����ȷ���ǣ� ��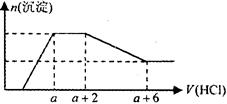
| A��ԭ��Һ��һ�����е��������ǣ�OH����SiO32����AlO2����CO32�� |
| B����Ӧ����γɵ���Һ�е�����ΪNaCl |
| C��ԭ��Һ��һ������Na2SO4 |
| D��ԭ��Һ�к���CO32- ��AlO2-�����ʵ���֮��Ϊ1��2 |
A
���������������ͼ���֪����ʼû�г������ɣ���Һ��Ӧ����OH������Fe3����Mg2����Al3����HCO3�����ܴ��ڣ�һ������Na���������μ�������ͼ���֪����Һ��Ӧ����AlO����SiO32����CO32����SO42����ȷ����A����ȷ��B����AlCl3������C��SO42����ȷ�������� D�����߷�����Ӧ�Ĺ�ϵʽ�ֱ�ΪCO32����2H����AlO2-~Al(OH)3��3H������ͼ�����ݿ�֪��CO32- ��AlO2-�����ʵ���֮��Ϊ1��3����
���㣺�������ӹ��桢��������֪ʶ��

ij��Һ�д��ڴ�����OH����Cl����CO32��������Һ�л����ܴ������ڵ���
| A��NH4+ | B��Ba2+ | C��Fe3+ | D��SO42�� |
�������ӷ���ʽ����ȷ���ǣ� ��
| A����̼������Һ����������������2CO32����SO2��H2O=2HCO3����SO32�� |
| B����NH4Al(SO4)2��Һ�е���Ba(OH)2��ҺʹSO42-������ȫ�� 2Ba2++NH4++Al3++2SO42- +4OH��= Al(OH)3�� +2 BaSO4��+ NH3��H2O |
| C��Cl2��FeI2��Һ��Ӧ����n��Cl2����n��FeI2��=1��1ʱ��2Fe2+ + 2I�� +2Cl2 =" 2" Fe3+ + 2I2 + 4Cl�� |
| D����1 mol/L NaAlO2��Һ��1.5 mol/L HCl��Һ�����������Ȼ�ϣ�6AlO2��+9H��+3H2O��5Al(OH)3��+Al3�� |
�ڸ��ӵ���ϵ�У�ȷ�ϻ�ѧ��Ӧ�Ⱥ�˳�������ڽ�����⣬���л�ѧ��Ӧ�Ⱥ�˳���ж���ȷ����( )
| A���������ʵ�����AlO2����OH����CO32������Һ�У���μ������AlO2����OH����CO32�� |
| B���������ʵ�����FeBr2��Fel2����Һ�У�����ͨ��������I����Br����Fe2�� |
| C���������ʵ�����Ba(OH)2��KOH����Һ�У�����ͨ��CO2��KOH��Ba(OH)2��K2CO3��BaCO3 |
| D���������ʵ�����Fe3����Cu2����H������Һ�м���п�ۣ�Fe3����Cu2����H����Fe2�� |
��������Һ�У�һ���ܴ����������������
| A��Na+��NH4+��NO3�� ��SO42�� |
| B��Na+��Cu2+��Cl����HCO3�� |
| C��Fe2+��Ag+�� I����NO3�� |
| D��K+��Al3+ ��Ba2+��SO42�� |
��Na2O2���뵽����Al3����Mg2����NH4���Ļ��Һ�в��ȣ�������������������ʵ�����mol)�����Na2O2�����ʵ����Ĺ�ϵ��ͼ��ʾ��ԭ��Һ��Al3����Mg2����NH4�������ʵ����ֱ�Ϊ
| A��2 mol��3 mol��8 mol |
| B��3 mol��2 mol��8 mol |
| C��2 mol��3 mol��4 mol |
| D��3 mol��2 mol��4 mol |
������ط�Ӧ�����ӷ���ʽ��д��ȷ����
| A������������������Fe(OH)3+3H+ = Fe3++3H2O |
| B������ͭ��Һ�����ԣ�Cu2+ + 2H2O ="=" Cu(OH)2��+ 2H+ |
C����̼�������Һ�мӹ���ʯ��ˮ�����ȣ�NH4++OH�D NH3��+H2O NH3��+H2O |
| D�����ữ�ĸ��������Һ����˫��ˮ��2MnO4�D+6H++5H2O2 = 2Mn2++5O2��+8H2O |
����ʵ����Ƽ����Ӧ�����ӷ���ʽ����ȷ����(����)
| A����FeCl3��Һ��ʴͭ��·�壺Cu��2Fe3��=Cu2����2Fe2�� |
| B��Na2O2��H2O��Ӧ�Ʊ�O2��Na2O2��H2O=2Na����2OH����O2�� |
| C������������ˮ�Ʊ������Cl2��H2O=2H����Cl����ClO�� |
| D����ϡ�����ữ��KMnO4��Һ��H2O2��Ӧ��֤��H2O2���л�ԭ�ԣ�2MnO4-��6H����5H2O2=2Mn2����5O2����8H2O |
�������ӷ���ʽ����ȷ���ǣ� ��
| A���������Ƽ���ˮ�� Na + 2H2O= Na+ + 2OH- + H2 �� |
B������ͨ��ˮ��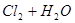   |
| C��FeBr2��Һ�м��������������ˮ 2Fe2++4Br-+3Cl2 =2Br2+6Cl-+2Fe3+ |
| D���Ȼ�����Һ�м��������ˮ A13++4NH3·H2O |