题目内容
在酸性溶液中,一定能大量共存的离子组是
| A.Na+、NH4+、NO3— 、SO42— |
| B.Na+、Cu2+、Cl-、HCO3— |
| C.Fe2+、Ag+、 I-、NO3— |
| D.K+、Al3+ 、Ba2+、SO42— |
A
解析试题分析:解离子大量共存问题需注意:(1)离子之间能反应不能大量共存,反应有四类:①复分解反应②氧化还原反应③相互促进的水解反应④络合反应;(2)注意题目中的隐含条件:颜色、酸碱性及限定条件等。A、组内离子在给定条件下不反应,能大量共存,正确;B、酸性溶液中,H+和HCO3—反应生成水和二氧化碳,不能大量共存,错误;C、酸性溶液中,Ag+ 和I-反应生成碘化银沉淀,H+、NO3—和Fe2+发生氧化还原反应,不能大量共存,错误;D、酸性溶液中,Ba2+和SO42—发生复分解反应生成硫酸钡沉淀,不能大量共存,错误。
考点:考查离子大量共存问题。

 黄冈创优卷系列答案
黄冈创优卷系列答案下列分子或离子在指定的分散系中能大量共存的一组是
| A.碱性溶液中:ClO-、Cl-、K+、Na+ |
| B.常温常压下气体:O2、N2、Cl2、NH3 |
| C.含有AlO2-的溶液:NO3-、HCO3-、Na+、K+ |
| D.氢氧化铁胶体: H+、K+、S2-、Br- |
下列表示对应化学反应的离子方程式正确的是
| A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH–= CO32-+ H2O |
| B.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-= NH3↑+H2O |
| C.将过量二氧化硫气体入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+ |
| D.硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |
下列有关离子方程式或热化学方程式书写正确的是
A.石灰乳与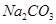 溶液混合: 溶液混合: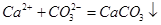 |
B.用惰性电极电解氯化镁溶液: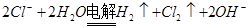 |
C.将碳与足量的浓硫酸共热反应后的气体混合物,通入过量氢氧化钠溶液中: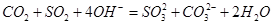 |
D.84消毒液和洁厕灵混合使用会产生有毒气体: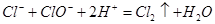 |
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。分析下列离子组在对应的溶液中一定能大量共存的是( )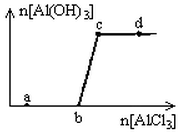
| A.a点对应的溶液中:Na+、Fe3+、SO42- 、NO3- |
| B.b点对应的溶液中:Na+、S2-、SO42- 、Cl- |
| C.c点对应的溶液中:Ag+、Ca2+、NO3-、Na+ |
| D.d点对应的溶液中:K+、NH4+、I-、HCO3- |
某溶液中可能含有OH—、CO32—、AlO2—、SiO32—、SO42—、HCO3—、Na+、Fe3+、Mg2+、
Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如下图所示。下列说法正确的是( )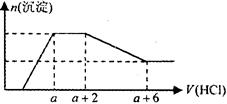
| A.原溶液中一定含有的阴离子是:OH—、SiO32—、AlO2—、CO32— |
| B.反应最后形成的溶液中的溶质为NaCl |
| C.原溶液中一定含有Na2SO4 |
| D.原溶液中含有CO32- 与AlO2-的物质的量之比为1∶2 |
下列离子组能大量共存的是
| A.含大量Al3+的溶液中:K+、Na+、NO3-、S2- |
| B.含大量AlO2-的溶液中:Na+、K+、NO3-、H+ |
| C.含大量H+的溶液中:I-、Cl-、NO3-、Na+ |
| D.含大量OH-的溶液中:CO32-、Cl-、F-、K+ |
在指定环境中,下列各组离子一定可以大量共存的是
①pH试纸变成深蓝色的溶液中:SO32-、S2O32-、Na+
②含有大量S2-的溶液中:Na+、ClO-、Cl-、CO32-
③AlCl3溶液中:K+、SiO32-、NH4+、NO3-
④中性溶液中:Cu2+、Fe3+、SO42-、Cl-
⑤加入铝粉放出氢气的溶液:Na+、Cl-、NH4+、NO3-
⑥在含有大量HCO3-的溶液中:K+、Na+、AlO2-、Br-
| A.①③④ | B.只有① | C.②④⑤ | D.①④⑥ |
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
| A.铈(Ce)元素在自然界中主要以单质形式存在 |
| B.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑ |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+ = Ce3++2Fe3+ |
D.四种稳定的核素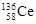 、 、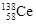 、 、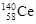 、 、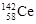 ,它们互称为同位素 ,它们互称为同位素 |