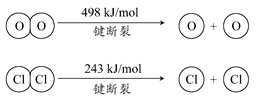
题目内容
(1)宇宙飞船上的氢氧燃料电池,其电池反应为:2H2+O2=2H2O,试写出电解质溶液若为盐酸时的正极反应式:______________。
(2)已知4 g甲烷气体充分燃烧生成CO2(g)和H2O(l)时,放出Q kJ的热量。写出表示甲烷燃烧热的热化学方程式:______________________。
(3)已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-Q1 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-Q2 kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=-Q3 kJ/mol
利用盖斯定律计算:FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变ΔH=________。
(1)O2+4H++4e-=2H2O (2)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-4Q kJ/mol (3)  kJ/mol。
kJ/mol。
解析

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案(16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是 。
已知:a.2CO(g)+O2(g)=2CO2(g) △H =-566.0 kJ·mol-1
b.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-890.0 kJ·mol-1
则CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的热化学方程式为 。
(2)工业上合成氨气的反应为:N2(g)+3H2(g) 2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率( )与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
)与体系总压强(P)、温度(T)的关系如图所示。回答下列问题: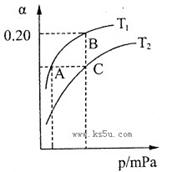
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= L2·mol-1。
②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
| HClO | HSCN | H2CO3 |
| K=3.210-8 | K=0.13 | Kl=4.210-7 K2=5.610-11 |
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为 > > > 。
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为 。
③25℃时,为证明HClO为弱酸,某学习小组的同学没计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是 (填下列各项中序号)。
a.用pH计测量0.1 mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c、用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
2012年11月16日,5名男孩被发现死于贵州省毕节市七星关区街头垃圾箱内,经当地公安部门初步调查,5名男孩是因在垃圾箱内生火取暖导致CO中毒而死亡。
(1)CO中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应的化学方程式可表示为CO+HbO2 O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的
O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的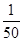 ,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的
,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的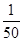 ,则吸入肺部CO的浓度不能超过______mol·L-1。
,则吸入肺部CO的浓度不能超过______mol·L-1。
(2)有如下三个与CO相关的反应:
Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=Q1,平衡常数K1
FeO(s)+CO(g) ΔH=Q1,平衡常数K1
Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
H2(g)+CO2(g) CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
在不同的温度下K1、K2、K3的数值如下:
| T/℃ | K1 | K2 | K3 |
| 700 | 1.47 | 2.38 | 0.62 |
| 900 | 2.15 | 1.67 | |
请回答下列问题:
①Q1、Q2、Q3的关系式:Q3=________。
②K1、K2、K3的关系式:K3=________,根据此关系式可计算出上表中900 ℃时,K3的数值为________(精确到小数点后两位)。可进一步推断反应H2(g)+CO2(g)
 CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g)
CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g) CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。A.缩小容器体积 B.降低温度
C.使用催化剂 D.设法增加H2O(g)的量
E.升高温度
(3)在一定条件下,使CO和O2的混合气体13 g充分反应,所得混合气体在常温下与足量的Na2O2固体反应,结果固体增重7 g,则原混合气体中CO的质量是________g。
煤制备CH4是一种有发展前景的新技术。
I. 煤炭气化并制备CH4包括以下反应:
C(s)+H2O(g)=CO(g)+H2 (g) ΔH 1 = +131 kJ/mol
CO(g) + H2O(g)=CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol
CO(g) + 3H2 (g)=CH4 (g)+ H2O(g) ΔH 3 = ?206 kJ/mol
(1)写出煤和气态水制备CH4(产物还有CO2)的热化学方程式 。
(2)煤转化为水煤气(CO和H2)作为燃料和煤直接作为燃料相比,主要的优点有 。
(3)写出甲烷—空气燃料电池(电解质溶液为KOH溶液)中负极的电极反应式 。
II. 对以上反应CO(g) + H2O(g)  CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
| 实验编号 | 容器体积/L | 温度/°C |
| ① | 2.0 | 1200 |
| ② | 2.0 | 1300 |
| ③ | 1.0 | 1200 |
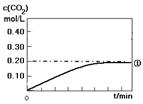
(1)实验①中c(CO2)随时间变化的关系见下图,请在答题卡的框图中,画出实验②和③中c(CO2)随时间变化关系的预期结果示意图。
(2)在与实验①相同的条件下,起始时充入容器的物质的量:n(CO)=n(H2O)=n(CO2) =n( H2)=1.00mol。通过计算,判断出反应进行的方向。(写出计算过程。)
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)===IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq) HOI(aq) ΔH2
HOI(aq) ΔH2
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
总反应的化学方程式为_________________________________,其反应热ΔH=________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3—(aq),其平衡常数表达式为________。
I3—(aq),其平衡常数表达式为________。
(3) 为探究Fe2+对O3氧化I-反应的影响(反应体系如上图),某研究小组测定两组实验中I3—浓度和体系pH,结果见下图和下表。
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
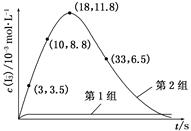
图2
①第1组实验中,导致反应后pH升高的原因是_____________________________
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是_____________________________________________
③第2组实验进行18 s后,I3—浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3—的平均反应速率(写出计算过程,结果保留两位有效数字)。
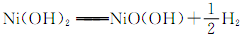 ②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应 。其放电时的正极的电极反应方程式为 。
②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应 。其放电时的正极的电极反应方程式为 。
 2Cl2+2H2O
2Cl2+2H2O