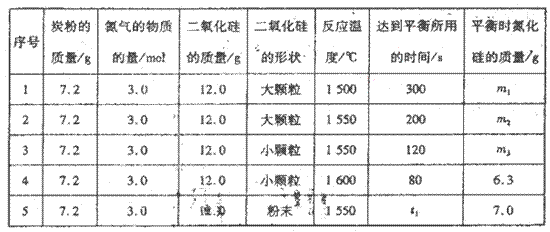
题目内容
在一只小烧杯里,加入20 g Ba(OH)2·8H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后加入10 g NH4+Cl晶体,并用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是 (该空2分)
(2)写出有关反应的化学方程式: (该空2分,余下各空1分)
该反应属 反应(填基本反应类型)。
(3)实验中观察到的现象有 、 且反应混合物成糊状,反应混合物呈糊状的原因是 。
(4)通过 现象,说明该反应为 热反应,这是由于反应物的总能量 生成物的总能量。
(1)搅拌使混合物充分接触并发生反应
(2)Ba(OH)2·8 H2O+2NH4Cl=BaCl2+2NH3↑+10H2O 复分解
(3)玻璃片上结冰而与小烧杯黏结在一起 有刺激性气味 反应发生时有水生成
(4)结冰 吸 小于
解析试题分析:(1)实验中玻璃棒的作用是使混合物充分接触并发生反应;
(2)该反应的化学方程式为(OH)2·8 H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,是复分解反应;
(3)实验中可看到玻璃片上结冰而与小烧杯黏结在一起,有刺激性气味,因为该反应中水生成,使反应混合物成糊状;
(4)通过结冰现象,说明该反应是吸热反应,根据吸热反应中物质的能量变化关系判断这是由于反应物的总能量小于生成物的总能量。
考点:考查吸热反应的实验,现象的判断,反应类型的判断,化学方程式的书写,反应的能量变化

 名校课堂系列答案
名校课堂系列答案已知;①Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
②Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=b kJ·mol-1。
测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
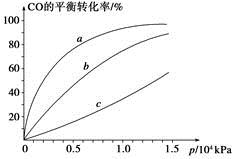
(2)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(3)下列关于反应①的说法正确的是 。
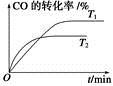
A.达到平衡后保持其他条件不变,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B. 在500 ℃下反应,当c(CO2)=c(CO)时,反应达到平衡状态
C.恒温恒容下,当容器内气体密度不再变化时,反应达到平衡状态
D.加压、升温和使用催化剂均可增大反应物的转化率
(4)由已知反应,写出Fe2O3(s)被CO(g)还原成FeO(s)的热化学方程式 。
(5)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-36)。
(6)新型锌空电池与锂电池相比,具有能量密度高、安全性好且成本低。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为_______。
若以该电池为电源,用惰性电极电解硫酸铜溶液,为保证阴极有6.4g铜析出,理论上至少需要标准状况下 L空气(空气中含氧气按20%计算)进入该电池。
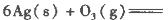
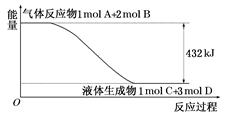
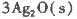 反应生成3 mol Ag2O(s)时放出的热量为
反应生成3 mol Ag2O(s)时放出的热量为
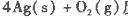 反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。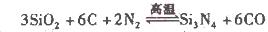
 2SO3(g) ΔH1 平衡常数为K1
2SO3(g) ΔH1 平衡常数为K1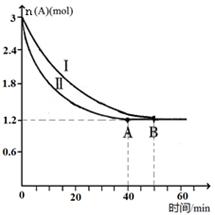
 CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。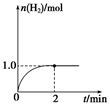
 CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。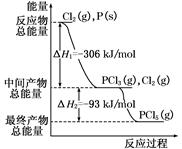
 2CO2(g)+N2(g)
2CO2(g)+N2(g)
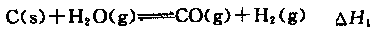


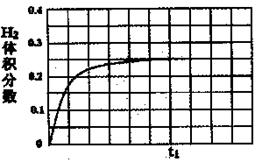
 CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,现往容器中继续通人3 mol CO,此时v(正) v(逆)(选填‘‘>”、“<’’或“=”),判断的理由 。
CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,现往容器中继续通人3 mol CO,此时v(正) v(逆)(选填‘‘>”、“<’’或“=”),判断的理由 。