��Ŀ����
ú�Ʊ�CH4��һ���з�չǰ�����¼�����
I. ú̿�������Ʊ�CH4�������·�Ӧ:
C(s)+H2O(g)=CO(g)+H2 (g) ��H 1 = +131 kJ/mol
CO(g) + H2O(g)=CO2 (g)+ H2(g) ��H 2 = ?41 kJ/mol
CO(g) + 3H2 (g)=CH4 (g)+ H2O(g) ��H 3 = ?206 kJ/mol
(1)д��ú����̬ˮ�Ʊ�CH4(���ﻹ��CO2)���Ȼ�ѧ����ʽ ��
(2)úת��Ϊˮú��(CO��H2)��Ϊȼ�Ϻ�úֱ����Ϊȼ����ȣ���Ҫ���ŵ��� ��
(3)д�����顪����ȼ�ϵ��(�������ҺΪKOH��Һ)�и����ĵ缫��Ӧʽ ��
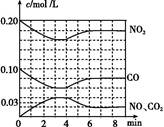
II. �����Ϸ�ӦCO(g) + H2O(g)  CO2 (g)+ H2(g) ��H 2 = ?41 kJ/mol����ʼʱ���ܱ������г���1.00 molCO��1.00 molH2O���ֱ��������ʵ�飬̽��Ӱ��ƽ������أ�����������ͬ�Ҳ������κθ���Ӧ��Ӱ�죩��ʵ���������±���
CO2 (g)+ H2(g) ��H 2 = ?41 kJ/mol����ʼʱ���ܱ������г���1.00 molCO��1.00 molH2O���ֱ��������ʵ�飬̽��Ӱ��ƽ������أ�����������ͬ�Ҳ������κθ���Ӧ��Ӱ�죩��ʵ���������±���
| ʵ���� | �������/L | �¶�/��C |
| �� | 2.0 | 1200 |
| �� | 2.0 | 1300 |
| �� | 1.0 | 1200 |
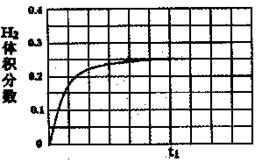
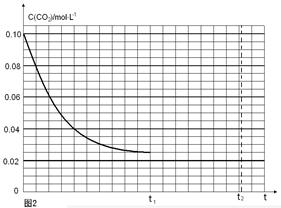
(1)ʵ�����c(CO2)��ʱ��仯�Ĺ�ϵ����ͼ�����ڴ���Ŀ�ͼ�У�����ʵ��ں͢���c(CO2)��ʱ��仯��ϵ��Ԥ�ڽ��ʾ��ͼ��
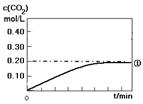
(2)����ʵ�����ͬ�������£���ʼʱ�������������ʵ�����n(CO)=n(H2O)=n(CO2) =n( H2)=1.00mol��ͨ�����㣬�жϳ���Ӧ���еķ���д��������̡���
I.��1��2C(s)+ 2H2O(g)= CH4 (g)+ CO2 (g) ��H = +15 kJ/mol ��3�� ��
(2)���ú�������ʣ���Լ��Դ���Լ��Դ����1�֣���������Ⱦ����1�֣�
(3)CH4��8e-+10OH-=CO32-+7H2O��2�֣�
II. (1) ��ͼ��ʾ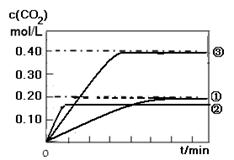
(2)Q�� K ��Ӧ���淴Ӧ��������CO��H2O�ķ����� ��1�֣�
������������� I. (1) ���ݸ�˹���ɺ���֪����ʽ��ú����̬ˮ�Ʊ�������Ȼ�ѧ����ʽ���ɷ���ʽ�١�2+��+�۶��ã����Ԧ�H=2��H 1+ ��H 2+��H 3 = +15 kJ/mol �������Ȼ�ѧ����ʽΪ��2C(s)+ 2H2O(g)= CH4 (g)+ CO2 (g) ��H = +15 kJ/mol ��
(2) ú����������ˮú����ȼ�ձ�ֱ��ȼ��ú���ӳ�֣������Դ�����ʣ�ͬʱȼú���ײ������꣬����ȼ��ˮú�������Լ�����Ⱦ��
(3)�ü�����ȼ���Ƴɵļ���ȼ�ϵ���У�����ʧ�������ɵ�CO2���������Һ�еļ��Խ��ʽ�һ����Ӧ����CO32-�������为���ķ�ӦʽΪ��CH4��8e-+10OH-=CO32-+7H2O��
II. (1) CO(g) + H2O(g)  CO2 (g)+ H2(g) �ķ�Ӧ��һ�����ȷ�Ӧ�������¶����ߣ���Ӧ�ķ�Ӧ���ʼӿ죬��ʹƽ�������ƶ���ʵ������߱�ʵ������߸���ﵽƽ�⣬����ƽ��ʱCO2��Ũ��Ҫ��һЩ�����֮�£�ʵ��۱��������С���������������ѹǿ�����ڷ�Ӧǰ������ϵ�����䣬��������ѹǿֻ������ѧ��Ӧ���ʣ����Dz��ܸı�ƽ�⣬���ʵ��۵����߱�ʵ��ٸ���ﵽƽ�⣬��ƽ��ʱCO2��Ũ����ʵ��ٵ�2������ͼ
CO2 (g)+ H2(g) �ķ�Ӧ��һ�����ȷ�Ӧ�������¶����ߣ���Ӧ�ķ�Ӧ���ʼӿ죬��ʹƽ�������ƶ���ʵ������߱�ʵ������߸���ﵽƽ�⣬����ƽ��ʱCO2��Ũ��Ҫ��һЩ�����֮�£�ʵ��۱��������С���������������ѹǿ�����ڷ�Ӧǰ������ϵ�����䣬��������ѹǿֻ������ѧ��Ӧ���ʣ����Dz��ܸı�ƽ�⣬���ʵ��۵����߱�ʵ��ٸ���ﵽƽ�⣬��ƽ��ʱCO2��Ũ����ʵ��ٵ�2������ͼ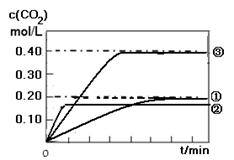
(2)����˼·���ȸ���ʵ��ٳ�������ʵ����ʵ�����ƽ��ʱ��CO2��Ũ�ȼ��������ͬ�¶��µ�ƽ�ⳣ��K��Ȼ��Ƚϴ�ʱ��Ũ����Q��ʵ��ٵ�Kֵ�Ĵ�С���Ӷ��ó���Ӧ���еķ���
���������
(2) ƽ��ʱn(CO2)=0.20mol/Lx2.0L=0.40mol
CO(g) + H2O(g) 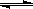 CO2 (g)+ H2(g)
CO2 (g)+ H2(g)
��ʼ���ʵ���/mol 1.00 1.00 1.00 1.00
�仯���ʵ���/mol 0.40 0.40 0.40 0.40
ƽ�����ʵ���/mol 0.60 0.60 0.40 0.40 ��1�֣�
K=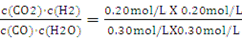 ="0.44" ��2�֣�
="0.44" ��2�֣�
Q=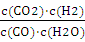 =
= =" 1.0" ��1�֣�
=" 1.0" ��1�֣�
Q�� K ��Ӧ���淴Ӧ��������CO��H2O�ķ����� ��1�֣�
���㣺���⿼����ǻ�ѧ��Ӧԭ��֪ʶ����Ҫ������˹����Ӧ�á��Ȼ�ѧ����ʽ����д��Ӱ�컯ѧƽ������ء�ͼ�����⡢��Ӧ������жϼ��㡣

 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á�
��1���ڹ̶��ݻ����ܱ������У��������»�ѧ��Ӧ��N2��g��+3H2��g�� 2NH3��g�� ��H=��92��4kJ/mol��
2NH3��g�� ��H=��92��4kJ/mol��
��ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
| T/K | 298 | 398 | 498 |
| ƽ�ⳣ��K | 4.1��106 | K1 | K2 |
���ж�K1 K2����д��>�� �� =����<������
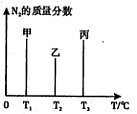
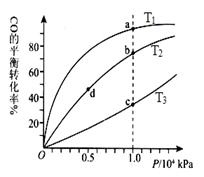
��2����2mol N2��3mol H2�ϳɰ����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䣬������������ͬ������£�ʵ���÷�Ӧ�����е�t minʱN2������������ͼ��ʾ����ʱ�ס��ҡ�������������һ���ﵽ��ѧƽ��״̬���� �����ﵽƽ��״̬ʱ��N2ת������͵��� ��
��3��NH3��CO2��120oC�����������¿��Ժϳɷ�Ӧ�������أ�CO2 +2NH3
 ��NH2��2CO +H2O
��NH2��2CO +H2O���ܱշ�Ӧ�����У����������NH3�ĺ����仯��ϵ��ͼ��ʾ
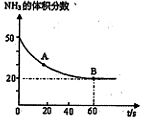
��������������Ϊ���壩����A�������Ӧ/����
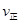 ��CO2�� B����淴Ӧ����
��CO2�� B����淴Ӧ���� ��CO2������д��>����=����<������NH3��ƽ��ת����Ϊ____ ��
��CO2������д��>����=����<������NH3��ƽ��ת����Ϊ____ ����4����֪�����Ȼ�ѧ����ʽ��
2H2��g��+O2��g��=2H2O��1�� ��H = -571��6kJ/mol
N2��g��+O2��g��
 2NO��g�� ��H =+180kJ/mol
2NO��g�� ��H =+180kJ/mol��д����NH3��ԭNO���Ȼ�ѧ����ʽ_ ��
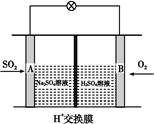
��5�������ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ����д���÷�Ӧ�Ļ�ѧ����ʽ____ ����ѧ�����ô�ԭ������Ƴɰ���������ȼ�ϵ�أ���ͨ�˰����ĵ缫�� ��������������������ڼ��������£�ͨ�˰����ĵ缫�����ĵ缫��ӦʽΪ ��
 2CO2(g)+N2(g)
2CO2(g)+N2(g)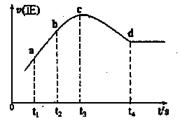
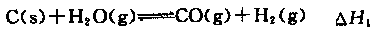


 CH3OH(g)����ƽ��ʱ�����CO��H2��CH3OH�ֱ�Ϊ1 mol��1 mol��1 mol�����������Ϊ3L�����������м���ͨ��3 mol CO����ʱv������ v���棩��ѡ���>������<������=�������жϵ����� ��
CH3OH(g)����ƽ��ʱ�����CO��H2��CH3OH�ֱ�Ϊ1 mol��1 mol��1 mol�����������Ϊ3L�����������м���ͨ��3 mol CO����ʱv������ v���棩��ѡ���>������<������=�������жϵ����� �� NH2CO2NH4(s) ��H1="a" kJ��mol��1
NH2CO2NH4(s) ��H1="a" kJ��mol��1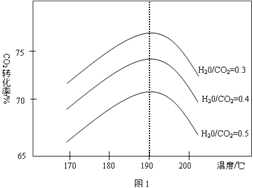
 CH3OH ( g ) ��H��-90.8 kJ��mol��1 ��һ�ݻ��ɱ���ܱ������г���10 mol CO ��20 molH2��CO ��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ�����ﵽƽ��״̬A ʱ�����������Ϊ20 L��
CH3OH ( g ) ��H��-90.8 kJ��mol��1 ��һ�ݻ��ɱ���ܱ������г���10 mol CO ��20 molH2��CO ��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯��ͼ��ʾ�����ﵽƽ��״̬A ʱ�����������Ϊ20 L��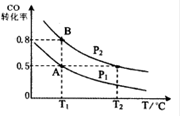
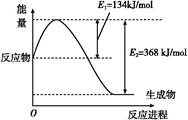
 2NO(g)����H="+179.5" kJ/mol
2NO(g)����H="+179.5" kJ/mol