题目内容
【题目】下列实验方案,不能达到相应实验目的的是
A.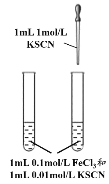 探究反应物浓度对化学平衡的影响
探究反应物浓度对化学平衡的影响
B.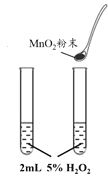 探究催化剂对反应速率的影响
探究催化剂对反应速率的影响
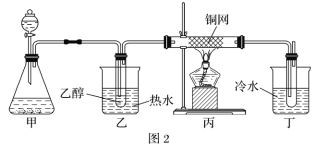
C.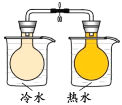 将NO2球浸泡在冷水和热水中,探究温度对化学平衡的影响
将NO2球浸泡在冷水和热水中,探究温度对化学平衡的影响
D. 比较乙醇中羟基氢原子和水分子中氢原子的活泼性
比较乙醇中羟基氢原子和水分子中氢原子的活泼性
【答案】A
【解析】
A.试管中加入的0.1mol/L FeCl3溶液的浓度太大,反应后溶液的颜色太深,再加入1mol/L KSCN后,颜色变化不明显,难以达到实验目的,A符合题意;
B.加入MnO2的试管,气泡产生的速率明显加快,可探究催化剂对 H2O2分解速率的影响,B不符合题意;
C.温度升高,气体的颜色加深,c(NO2)增大,温度降低,气体的颜色变浅,c(NO2)减小,由此可探究温度对化学平衡的影响,C不符合题意;
D.钠与水反应比钠与乙醇反应剧烈得多,由此可比较两种物质中活性氢的活泼性,D不符合题意;
故选A。

【题目】在一容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
10min | 20min | 30min | 40min | 50min | 60min | |
300℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
500℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
A. 该反应的焓变ΔH > 0,升高温度K增大
B. 300℃时,0-20 min H2的平均反应速率 v (H2)= 0.003mol/(L·min)
C. 采取加压、增大H2浓度、加入催化剂的措施都能提高CO的转化率
D. 500℃下,向该容器中初始加入0.1 mol CO和0.3 mol H2,依据现有数据可计算反应达平衡后甲醇的浓度
【题目】某学生为探究AgCl沉淀的溶解和转化,其实验方案及记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合,过滤,得滤液X和白色沉淀Y | |
Ⅱ.向滤液X 中滴加几滴饱和KI溶液 | 生成黄色沉淀M |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀Y 转化为黑色沉淀Z |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀Y逐渐溶解 |
(1)由步骤Ⅱ的现象可推测,滤液 X 中除了含有Na+、NO3-,还含有的离子有_____。
(2)写出步骤Ⅲ中生成黑色沉淀 Z 的离子方程式为_________________,白色沉淀Y 转化为黑色沉淀 Z 的主要原因是___________。
(3)已知:Ag+ + 2NH3· H2OAg(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因__________________。
(4)为了进一步探究银的难溶化合物沉淀溶解的多样性,该同学又做了如下对比实验 V:
①取少量黑色沉淀 Z 和黄色沉淀 M,分置于两支试管中
②然后分别滴加同体积同浓度的稀硝酸,观察到黄色沉淀 M 不溶解,黑色沉淀 Z 溶解,并且有无色气体产生。综合实验Ⅱ至实验 V 的信息,下列预测正确的是__________
A.黑色沉淀 Z 比黄色沉淀 M 更难溶于水
B.黑色沉淀 Z 溶解于稀硝酸是因为发生了氧化还原反应
C.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
D.在步骤Ⅳ之后,继续滴加浓硝酸后又有 AgCl 沉淀生成