题目内容
【题目】已知短周期元素的离子![]() 都具有相同的电子层结构,则下列叙述正确的是( )
都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径A>B>D>C B. 原子序数d>c>b>a
C. 离子半径C>D>B>A D. 单质的还原性A>B>D>C
【答案】C
【解析】已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则四种离子核外的电子数相同,即a-2=b-1=c+3=d+1,原子序数a>b>d>c,A、B处于同一周期,C、D处于同一周期,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属,结合化合价可知,A为Mg元素、B为Na元素、C为N元素、D为F元素。A. 同一周期从左至右,原子半径逐渐减小,同一主族从上至下,原子半径逐渐增大,则原子半径Na>Mg>N>F,故A错误;B. 由上述分析可知,原子序数a>b>d>c,故B错误;C. 具有相同电子层结构的离子,原子序数越大,离子半径越小,则离子半径N3->F->Na+>Mg2+,故C正确;D. 同一周期从左至右,元素的金属性逐渐减弱,则单质的还原性Na>Mg,N和F元素是非金属,单质主要体现氧化性,故D错误;答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为: .
(2)装置B中饱和食盐水的作用是;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 .
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为色,说明氯的非金属性大于溴.
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是 .
(6)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式: , 判断改用NaHSO3溶液是否可行(填“是”或“否”).
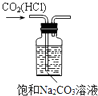
【题目】利用如图所示装置进行下列实验,能得到相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硝酸 | Na2CO3 | NaSiO3溶液 | 酸性:硝酸>碳酸>硅酸 | |
B | 浓盐酸 | MnO2 | 石蕊溶液 | 石蕊溶液先变红后褪色 | |
C | 浓硫酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、强氧化性 |
A. A B. B C. C D. D