题目内容
下列比较中,正确的是
| A.同温和同物质的量浓度时,HF比HCN易电离,则溶液pH:NaF>NaCN |
| B.物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| C.0.1mol/L的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小 |
| D.体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等量的锌粉,前者用时长 |
B
解析试题分析:A、同温和同物质的量浓度时,HF比HCN易电离,这说明HF的酸性强于HCN。酸性越弱,相应的钠盐越容易水解,碱性越强,pH越大,则溶液pH:NaF<NaCN,A不正确;B、根据物料守恒可知,物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S),B正确;C、醋酸是弱酸,存在电离平衡CH3COOH CH3COO-+H+,稀释促进电离,但溶液的酸性降低,氢离子减小。根据水的离子积常数可知,溶液中OH-浓度增大,C不正确;D、氯化铵溶液中NH4+水解NH4++H2O
CH3COO-+H+,稀释促进电离,但溶液的酸性降低,氢离子减小。根据水的离子积常数可知,溶液中OH-浓度增大,C不正确;D、氯化铵溶液中NH4+水解NH4++H2O NH3·H2O+H+,溶液显酸性,盐酸是强酸,完全电离。所以体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等量的锌粉,前者反应速率快,用时少,D不正确,答案选B。
NH3·H2O+H+,溶液显酸性,盐酸是强酸,完全电离。所以体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等量的锌粉,前者反应速率快,用时少,D不正确,答案选B。
考点:考查pH判断、盐类水解、弱电解质的电离、反应速率以及溶液中离子浓度关系比较

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
下列溶液中微粒浓度关系一定正确的是
| A.将pH=5的H2SO4溶液稀释1×103后,c(H+):c(SO42-)=2:1 |
B.醋酸与醋酸钠的 的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) 的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) |
C.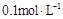 的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) 的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) |
| D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)<c(C2O42-) |
常温下,往c1mo1/L的醋酸溶液中滴加同体积的c2 mo1/L的氢氧化钠溶液后,所得溶液的pH=7,则
| A.酸碱恰好中和 | B.c1=c2 |
| C.滴人酚酞溶液呈浅红色 | D.所得溶液c(Na+)=c(CH3COO一) |
对pH值相同的盐酸和醋酸两种溶液的说法正确的是
| A.中和碱的能力相同 | B.盐酸和醋酸的物质的量浓度相同 |
| C.OH-的物质的量浓度相同 | D.H+的物质的量浓度不同 |
中和滴定是一种操作简单,准确度高的定量分析方法。实际工作中也可以利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点,下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是
| A.用标准NaOH溶液滴定盐酸溶液以测定其浓度:酚酞试液——浅红色 |
| B.用标准FeCl3溶液滴定KI以测定其浓度:淀粉溶液——蓝色 |
| C.用标准酸性KMnO4溶液滴定Na2SO3溶液以测定其浓度:KMnO4溶液——紫红色 |
| D.利用“Ag++SCN-=AgSCN↓”原理,用标准KSCN溶液滴定AgNO3溶液以测定其浓度:FeCl3溶液——红色 |
下列液体均处于25 ℃,有关叙述正确的是( )
| A.Na2CO3溶液中,c(OH-)-c(H+)=c(HCO3-) +2c(H2CO3) |
| B.AgCl在同浓度的MgCl2和KCl溶液中的溶解度相同 |
| C.将稀氨水逐滴加入稀硫酸中,当溶液pH =7时,c(SO42-) >c(NH4+) |
| D.Na2S溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
某温度下,0.1 mol·L-1 NaHCO3溶液pH=10,下列判断正确的是( )。
| A.c(OH-)=10-4 mol·L-1 |
| B.加入少量NaOH固体,c(Na+)和c(HCO3—)均增大 |
| C.c(Na+)+c(H+)=c(HCO3—)+c(OH-) |
| D.c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3) |
 随着温度的升高而增大,说明水的电离是放热反应
随着温度的升高而增大,说明水的电离是放热反应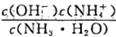 增大
增大