题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、HCO3-、NO3- |
| B.1.0 mol·L-1KNO3溶液:H+、Fe2+、Cl-、SO42- |
| C.含有0.1 mol·L-1 Ca2+溶液:Na+、K+、CO32-、Cl- |
| D.澄清透明的溶液:Na+、K+、MnO4-、[Al(OH)4]- |
D
解析试题分析:c(H+)/c(OH-)=1×1014的溶液显酸性,HCO3-即不存在酸性溶液,也不存在碱性溶液,A选项不正确;1.0 mol·L-1KNO3溶液中含有H+,具有强氧化性,能将Fe2+氧化成Fe3+,B选项不正确,;Ca2+与CO32-反应生成CaCO3,不能共存,C选项不正确;澄清透明的溶液不是指无色,故D选项正确,。
考点:考查离子共存。

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
下列有关叙述正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.强电解质溶液的导电能力一定比弱电解质溶液的强 |
| C.SO3溶于水,其水溶液能导电,故SO3是电解质 |
| D.升高温度,可提高活化分子百分数,使有效碰撞增多,化学反应速率加快 |
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴加入过量的稀盐酸
③向NaAlO2溶液中通入过量的CO2
④向澄清石灰水中通入缓慢过量的CO2
| A.①② | B.①④ | C.①③ | D.②③ |
能正确表示下列反应的离子反应方程式为
| A.NH4HCO3溶于过量的浓KOH溶液中:NH4++ OH-= NH3↑+ H2O |
| B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -="2" Al(OH)3↓+3BaSO4↓ |
| C.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2="2" Fe3++2 Br2+6 Cl- |
| D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O |
下列有关说法正确的是
A.含有大量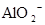 的溶液中:K+、 的溶液中:K+、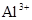 、 、 、 、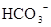 可共存 可共存 |
B.CO(g)的燃烧热是283.0kJ·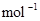 ,则 ,则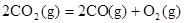 反应的 反应的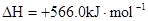 |
| C.用NaOH溶液雕刻工艺玻璃上的纹饰 |
D.在某钠盐溶液中含有等物质的量的 、 、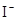 、 、 、 、 、 、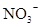 、 、 中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有 中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有 |
常温,下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1的溶液中: I-、NO3-、SO42-、Na+ |
| B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| C.c(H+)/c(OH-)=1012的溶液中: NH4+、Al3+、NO3-、Cl- |
| D.c(Fe3+)="0.1" mol·L-1的溶液中:K+、ClO-、SO42-、SCN- |
下列离子方程式正确的是( )
| A.足量的CO2通入饱和碳酸钠溶液中: CO2+CO32-+H2O→2HCO3- |
B.FeSO4溶液在空气中变质:4Fe2++O2+2H2O 4Fe3++4OH- 4Fe3++4OH- |
| C.次氯酸钙溶液中通入足量二氧化硫:Ca2++ClO-+SO2+H2O→CaSO4↓+Cl-+2H+ |
| D.碳酸氢镁溶液中加入过量石灰水 Mg2++2HCO3-+2Ca2++4OH— ®2CaCO3↓+ Mg(OH)2↓+ 2H2O |
在pH=13的无色溶液中,下列各组离子能大量共存的是
A.K+、Na+、 、 、 | B.Na+、 、 、 、Cl- 、Cl- |
C.K+、Na+、 、Br- 、Br- | D.K+、Cu2+、Cl-、 |
在指定的条件下,下列各组微粒一定能大量共存的是 ( )
| A.溶有大量SO2的溶液中:Ba2+、NO3-、Na+、Cl- |
| B.酸性K2Cr2O7溶液中:C2H5OH、S2-、SO42-、K+ |
| C.室温下,C(H+)="1×10-13" mol·L-1的溶液中:NO3-、Cl-、SO32-、Na+ |
| D.遇K3[Fe(CN)6]得蓝色沉淀的溶液中:AlO2-、NH4+、Ba2+、SCN- |