题目内容
下列离子方程式正确的是( )
| A.足量的CO2通入饱和碳酸钠溶液中: CO2+CO32-+H2O→2HCO3- |
B.FeSO4溶液在空气中变质:4Fe2++O2+2H2O 4Fe3++4OH- 4Fe3++4OH- |
| C.次氯酸钙溶液中通入足量二氧化硫:Ca2++ClO-+SO2+H2O→CaSO4↓+Cl-+2H+ |
| D.碳酸氢镁溶液中加入过量石灰水 Mg2++2HCO3-+2Ca2++4OH— ®2CaCO3↓+ Mg(OH)2↓+ 2H2O |
D
解析试题分析:A选项由于碳酸钠的溶解度大于碳酸氢钠,所以往饱和碳酸钠中通入CO2会使碳酸氢钠析出,有沉淀生成,所以A错误;FeSO4溶液在空气中变质生成Fe(OH)3,B错误;次氯酸根有强氧化性,把SO2氧化为SO42-,生成CaSO4 沉淀,但是由于SO2 过量,据以少定多的原则,ClO- 前应该配2,所以C错误;D根据以少定多原则配平正确,故选D。
考点:本题考查的是离子方程式的正误判断。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
下列化学反应的离子方程式书写正确的是
| A.氯气通入氯化亚铁溶液中:Fe2++Cl2="=" 2Cl-+Fe3+ |
| B.氯气与氢氧化钠溶液反应:Cl2 + 2OH-="=" Cl-+ ClO- + H2O |
C.大理石与稀盐酸反应:CO + 2H+== CO2 ↑ + H2O + 2H+== CO2 ↑ + H2O |
D.铜与稀硝酸反应:Cu + H+ + NO == Cu2+ + NO↑ + H2O == Cu2+ + NO↑ + H2O |
下列各组离子,在pH=0的溶液中可以大量共存的是( )
| A.Al3+、Fe3+、Br—、SO42— |
| B.K+、Ca2+、SO42—、Cl— |
| C.Na+、Cu2+、I—、NO3— |
| D.NH4+、K+、HPO42—、Cl— |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、HCO3-、NO3- |
| B.1.0 mol·L-1KNO3溶液:H+、Fe2+、Cl-、SO42- |
| C.含有0.1 mol·L-1 Ca2+溶液:Na+、K+、CO32-、Cl- |
| D.澄清透明的溶液:Na+、K+、MnO4-、[Al(OH)4]- |
水溶液中能大量共存的一组离子是:
| A.K+、Al3+、NO3-、CO32- | B.H+、Na+、Fe2+、NO3- |
| C.Na+、Ba2+、Cl-、NO3- | D.K+、NH4+、SO42-、OH- |
在无色透明溶液中,能够大量共存的离子组是
| A.Cu2+、Na+、SO42-、OH- | B.K+、Na+、HCO3-、NO3- |
| C.OH-、CO32--、Ca2+、Fe3+ | D.Ba2+、Na+、OH-、SO42- |
关于溶液的下列说法正确的是( )
| A.c(H+)︰c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 |
| B.水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 |
C.往0.1mol/LCH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中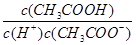 增大 增大 |
| D.等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 |
能在水溶液中大量共存的一组离子是
A.H+、I-、NO 、SiO32- 、SiO32- | B.NH4+、OH-、Cl-、HCO |
C.K+、SO42-、Cu2+、NO | D.Al3+、Mg2+、SO 、CO 、CO |
下列离子方程式书写正确的是
| A.NaAlO2溶液中通入过量的CO2:2AlO2–+3H2O+CO2=2Al(OH)3+CO32– |
| B.明矾溶液中滴加Ba(OH)2溶液至SO42–恰好完全沉淀:Al3++Ba2++ SO42–+3OH–=BaSO4+Al(OH)3 |
| C.200 mL 2 mol·L–1的FeBr2溶液中通入11.2 L标准状况下的氯气:4 Fe2++6Br–+5Cl2=4Fe3++3Br2+ 10Cl– |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO–+2Fe(OH)3=2FeO42–+3Cl–+H2O+4H+ |