题目内容
在指定的条件下,下列各组微粒一定能大量共存的是 ( )
| A.溶有大量SO2的溶液中:Ba2+、NO3-、Na+、Cl- |
| B.酸性K2Cr2O7溶液中:C2H5OH、S2-、SO42-、K+ |
| C.室温下,C(H+)="1×10-13" mol·L-1的溶液中:NO3-、Cl-、SO32-、Na+ |
| D.遇K3[Fe(CN)6]得蓝色沉淀的溶液中:AlO2-、NH4+、Ba2+、SCN- |
C
解析试题分析:A、在酸性溶液中亚硫酸根离子会被硝酸氧化为硫酸根离子,硫酸根离子与钡离子结合什么不溶 于酸的硫酸钡,错误;B、重铬酸钾在酸性条件下,氧化性最强,+6价的铬会把乙醇氧化,自身被还 原,错误;C、正确;D、偏铝酸跟离子会和铵根离子发生双水解,错误。
考点:离子共存。

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、HCO3-、NO3- |
| B.1.0 mol·L-1KNO3溶液:H+、Fe2+、Cl-、SO42- |
| C.含有0.1 mol·L-1 Ca2+溶液:Na+、K+、CO32-、Cl- |
| D.澄清透明的溶液:Na+、K+、MnO4-、[Al(OH)4]- |
能在水溶液中大量共存的一组离子是
A.H+、I-、NO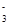 、SiO32- 、SiO32- | B.NH4+、OH-、Cl-、HCO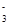 |
C.K+、SO42-、Cu2+、NO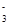 | D.Al3+、Mg2+、SO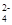 、CO 、CO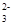 |
在由水电离产生的H+的浓度为1×10-13mol/L的溶液中,一定能大量共存的离子组是( )
①K+、Cl-、NO3-、S2-②K+、Fe2+、I-、SO42-
③Na+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3-
⑤K+、Ba2+、Cl-、NO3-
| A.①③ | B.③⑤ | C.③④ | D.②⑤ |
下列反应的离子方程式不正确的是
| A.NaOH溶液与稀H2SO4反应:H++OH—=H2O |
| B.NaHCO3与NaOH两溶液反应:HCO3-+OH—=CO32-+H2O |
| C.金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| D.AlCl3溶液中滴加过量的氨水:Al3++4OH-=AlO2-+2H2O |
下列离子方程式中正确的是
| A.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2+ + OH- + H+ + SO42-= BaSO4↓+ H2O |
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++ OH-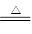 NH3↑+ H2O NH3↑+ H2O |
| C.稀硝酸和过量的铁屑反应:3 Fe + 8H+ +2 NO3- =" 3" Fe3+ +2 NO↑ + 4 H2O |
| D.KI溶液与H2SO4酸化的H2O2溶液混合:2 I- + H2O2 + 2 H+ ="2" H2O + I2 |
下列离子方程式书写正确的是
| A.NaAlO2溶液中通入过量的CO2:2AlO2–+3H2O+CO2=2Al(OH)3+CO32– |
| B.明矾溶液中滴加Ba(OH)2溶液至SO42–恰好完全沉淀:Al3++Ba2++ SO42–+3OH–=BaSO4+Al(OH)3 |
| C.200 mL 2 mol·L–1的FeBr2溶液中通入11.2 L标准状况下的氯气:4 Fe2++6Br–+5Cl2=4Fe3++3Br2+ 10Cl– |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO–+2Fe(OH)3=2FeO42–+3Cl–+H2O+4H+ |
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A.K+、MnO4-、Na+、Cl- | B.K+、Na+、NO3-、CO32- |
| C.Na+、H+、NO3-、SO42- | D.Fe3+、Na+、Cl-、SO42- |
在下列溶液中,能大量共存的一组离子是( )
| A.pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- |
| B.通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ |
| C.c(Al3+)=0.1 mol/L的溶液中:Na+、K+、AlO2-、SO42- |
| D.由水电离出的c(H+)=1×10-13 mol/L的溶液中:Na+、HCO3-、Cl-、Br- |