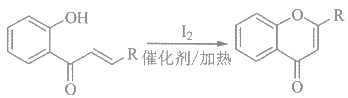
题目内容
【题目】分别按下图 A、B、C 所示装置进行实验,三个烧杯里的溶液为同浓度的稀硫酸。回答下列问题:
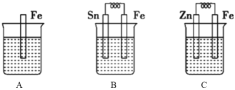
(1)下列叙述中,不正确的是___________。
A.B 中铁片是负极,C 中铁片是正极 B.三个烧杯中铁片表面均无气泡产生 C.产生气泡的速率 A 中比B中慢 D.C 溶液中![]() 向Zn片电极移动
向Zn片电极移动
(2)装置 B中能量转化的主要形式是________________;
(3)装置 B中正极反应式为__________________;
(4)装置 C负极反应式为________________________;
(5)装置 A 中发生反应的离子方程式________________;
(6)Ba(OH)2·8H2O 晶体与 NH4C1晶体的反应属于_______反应(填“吸热”或“放热”)若把此反应设计成原电池,你认为是否可行?_______ (填“是”或“否”)。
【答案】B 化学能转化为电能 2H++2e-=H2↑ Zn—2e-=Zn2+ 2H++Fe=H2↑+Fe2+ 吸热 否
【解析】
形成原电池的条件为:①自发进行的氧化还原反应,②形成闭合回路,故A不是原电池,B、C为原电池;根据原电池正负极判断方式:一般活泼金属做负极,故B中负极铁发生氧化反应,C中铁做正极,发生还原反应,据此解答。
(1) A.根据金属活动性:Zn>Fe>Sn, 一般活泼的金属失电子作负极,因此B中铁片是负极,C中铁片是正极,故A正确;
B.A烧杯中铁直接反应,表面有气泡,C中铁作正极,烧杯中铁表面有气泡,故B错误;
C.B形成原电池,比A中反应速率快,产生气泡的速率A比B中慢,故C正确;
D.原电池中阴离子向负极移动,B中铁片为负极,因此B溶液中![]() 向铁片电极移动,故D
向铁片电极移动,故D
正确;故答案为:B;
(2).装置B形成原电池,变化过程中能量转化的主要形式是:化学能转化为电能;
(3).Sn作正极,正极上氢离子得电子生成氢气,装置B中正极反应式为::2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(4).活泼金属Zn作负极,负极反应式为: Zn—2e-=Zn2+,故答案为:Zn—2e-=Zn2+;
(5).A中时铁直接与硫酸发生置换反应,故答案为:2H++Fe=H2↑+Fe2+;
(6).常温下,自发进行的氧化还原反应且为放热反应可设计成原电池,Ba(OH)2·8H2O 晶体与 NH4C1晶体的反应为吸热反应,且为非氧化还原反应,不能设计成原电池,故答案为:吸热;否。

【题目】硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
Ⅰ.SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)=CO2(g)+CaO(s) ΔH=+178.2kJ/mol
SO2(g)+CaO(s)=CaSO3(s) ΔH=-402kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-234.2kJ/mol
写出石灰石脱硫的热化学反应方程式___________________________。
Ⅱ.在一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /mol·L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~20min 时段,反应速率υ(N2O)为_____。
②若N2O起始浓度c0为0.150mol·L-1,则反应至30min时N2O的转化率α=____,比较不同起始浓度时N2O的分解速率:υ(c0=0.150mol·L-1)____υ(c0=0.100 mol·L-1)(填“>、=或<”)
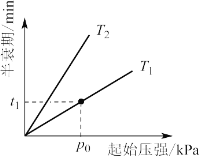
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O耗一半时所需的相应时间),则T1__T2(填“>、=或<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=__(用 p0表示)。
【题目】下表是A、B、C、D四种常见有机物的相关信息。根据表中信息回答下列问题:
有机物A | 有机物B | 有机物C | 有机物D |
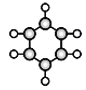
①可用于果实催熟 ②比例模型为
| ①由C、H两种元素组成②球棍模型为
| ①生活中常见的液态有机物,分子中碳原子数与有机物A相同 ②能与Na反应,但不能与NaOH反应 | ①相对分子质量比有机物C大14 ②能由有机物C氧化生成 |
(1)有机物B的分子式为___。
(2)下列有关有机物A、B的说法正确的是___。
a.A、B均可使酸性KMnO4溶液褪色
b.A、B分子中所有的原子在同一平面内
c.等质量的A、B完全燃烧,消耗氧气的量相同
d.A、B分子均含有官能团碳碳双键,能发生加成反应
(3)写出有机物C的同分异构体的结构简式___。
(4)在一定条件下,有机物C与有机物D反应能生成具有水果香味的物质E,其化学反应方程式为___;某次实验中以6.0gD为原料制得4.84gE,则反应E的产率为____。