题目内容
(11分)某研究性学习小组为探究铜、锌与浓盐酸的反应,设计实验探究方案如下:
实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化钾溶液、稀硝酸溶液
实验记录:
背影资料:
请你参与以下探究:
(1)实验A反应速度明显比B小,原因是 。
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理,理由是 。
②某同学作了如下猜想:是否成立?请你设计实验方案加入验证。
(3)某同学对实验D中的白色沉淀进行分析:“不可能是CuCl2,因为CuCl2能溶于水且溶液显蓝色;也不可能是ZnCl2,因为稀释后溶液更稀,不会析出ZnCl2晶体。若利用资源卡片资料大胆猜想,白色沉淀可能是CuCl。请你帮他设计验证方案(若有多处方案,只设计两个)。
(4)指导老师肯定了实验D中的白色沉淀是CuCl;并措出生成沉淀的原因,实际上是[CuCl4]2等离子与CuCl(s)、Cl三者之间所形成的沉淀溶解平衡移动的结果。请写出这一平衡关系式(用离子方程式表示): 。
实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化钾溶液、稀硝酸溶液
实验记录:
背影资料:
|
|
请你参与以下探究:
(1)实验A反应速度明显比B小,原因是 。
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理,理由是 。
②某同学作了如下猜想:是否成立?请你设计实验方案加入验证。
| 猜想 | 验证方法 | 预测现象及结论 |
| 认为铜片中可能含有锌等杂质 | | |
| 猜想 | 预计验证方法 | 猜想的现象与结论 |
| 白色沉淀是氯化亚铜 | | |
| | |
.(11分)
(1)铜锌及浓盐酸一起组成了原电池,加快了反应速率 …………2分
(2)①没道理,因为H2本身难溶于水 …………1分
②(2分)
(3)(4分)
(4)[CuCl4]3-(aq) CuCl(s)+3Cl-(aq)
(1)铜锌及浓盐酸一起组成了原电池,加快了反应速率 …………2分
(2)①没道理,因为H2本身难溶于水 …………1分
②(2分)
| 将铜片加入稀硫酸中,并微热 | 若无气体放出,则不含锌等活泼金属杂质;若有气体则有锌等杂质 |
(3)(4分)
| 白色沉淀是氯化亚铜 | 向白色沉淀中加入稀HNO3等强氧化剂 | 溶液变蓝色,说明是一价铜 |
| 向氯化亚铜悬浊液中加入氯化钾溶液 | 如白色沉淀消失且得无色溶液,则原溶液为氯化亚铜,否则不是 |
略

练习册系列答案
相关题目
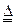 2Cu2O+O2↑
2Cu2O+O2↑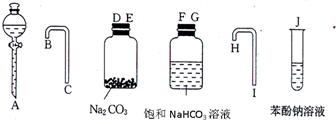
 园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装
园底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装 通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
 。
。 分液,分离方法②是蒸馏,分离方法③是分液
分液,分离方法②是蒸馏,分离方法③是分液 ,乙酸和乙醇的酯化反应是分两步反应进行的,其反应的过程如下:
,乙酸和乙醇的酯化反应是分两步反应进行的,其反应的过程如下: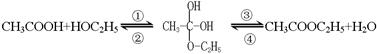
 基。为了探究酯化反应中的脱水方式,一般采取同位素示踪法,你认为用18O同位素进行标记时,下列标记正确的是 。
基。为了探究酯化反应中的脱水方式,一般采取同位素示踪法,你认为用18O同位素进行标记时,下列标记正确的是 。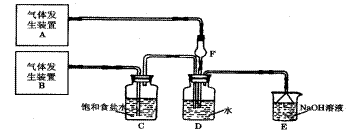

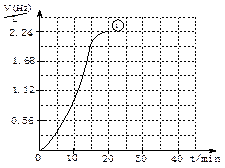 (2)右图为实验①的“H2—t”曲线图,若
(2)右图为实验①的“H2—t”曲线图,若