题目内容
向0.1mol/L的草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色总是先慢后快。对其原因,某研究性学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究:
(1) 该研究性学习小组的实验目是: 。
(2)该研究性学习小组进行实验时所用的方法是科学实验中常用的一种方法,该方法
叫 法;
(3)设计第一组实验对应的假设是 ;
(4)由第二组实验和第三组实验得出的结论有 (填序号)
①温度对该反应速率影响不大
②硫酸对草酸和高锰酸钾溶液的反应有影响
③加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应,而加入大量硫酸,反应速率比较慢
④在酸性范围呢,PH值越小,可能对反应越有利
(5)据有关现象写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:
。
| 实验组别 | 试管标号 | 所加药品 | 实验现象 (褪色时间) |
| 一 (室温) | 1 | 10ml 0.1mol/L的草酸(H2C2O4)溶液(用少量硫酸酸化)0.1mol/L的KMnO4溶液适量 + 少量硫酸锰固体 | 2s |
| 2 | 10ml 0.1mol/L的草酸(H2C2O4)溶液(用少量硫酸酸化)0.1mol/L的KMnO4溶液适量 | 30s | |
| 二 (室温) | 1 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液+10滴稀硫酸 | 90s |
| 2 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 | 100s | |
| 三 (65℃ 的水浴) | 1 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的 KMnO4溶液 +10滴稀硫酸 | 90s |
| 2 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 +1ml稀硫酸 | 100s | |
| 3 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 +2ml稀硫酸 | 120s |
(2)该研究性学习小组进行实验时所用的方法是科学实验中常用的一种方法,该方法
叫 法;
(3)设计第一组实验对应的假设是 ;
(4)由第二组实验和第三组实验得出的结论有 (填序号)
①温度对该反应速率影响不大
②硫酸对草酸和高锰酸钾溶液的反应有影响
③加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应,而加入大量硫酸,反应速率比较慢
④在酸性范围呢,PH值越小,可能对反应越有利
(5)据有关现象写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:
。
(1)探究温度、浓度、催化剂、pH值等因素对化学反应速率影响。(4分)(1个得1分)
(2)对照(对比)实验 (或控制变量)(3分)
(3)假设一:Mn2+可能是反应的催化剂;(3分)(写成硫酸锰扣1分)
(4)①②③(3分)(漏一个扣1分)
(5)5 H2C2O4+2MnO4—+6H+=2Mn2++10CO2↑+8H2O(3分)
考查实验数据分析、条件对反应速率的影响
(1)从表格中的数据可看出,使反应物在不同的温度、浓度、pH值、催化剂条件下反应,比较反应时间,研究它们对反应速率的影响
(2)通过控制变量进行对比实验二组实验和第三组实验数据可看出,
(3)①②③正确
(4)由化合价升降守恒、电荷守恒及原子守恒可配平:5 H2C2O4+2MnO4—+6H+=2Mn2++10CO2↑+8H2O
(1)从表格中的数据可看出,使反应物在不同的温度、浓度、pH值、催化剂条件下反应,比较反应时间,研究它们对反应速率的影响
(2)通过控制变量进行对比实验二组实验和第三组实验数据可看出,
(3)①②③正确
(4)由化合价升降守恒、电荷守恒及原子守恒可配平:5 H2C2O4+2MnO4—+6H+=2Mn2++10CO2↑+8H2O

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
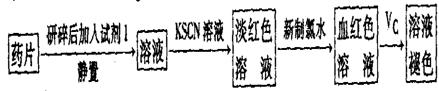
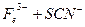
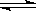
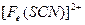 。
。 。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
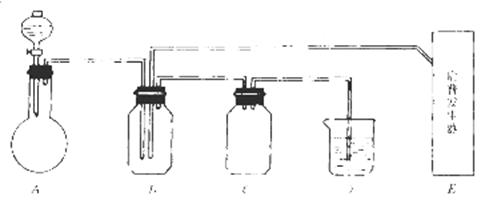
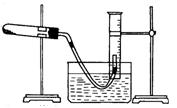

 2Cu2O+O2↑
2Cu2O+O2↑

 。
。 的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式: mol/L(
的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式: mol/L( 用含a的代数式表达,若不能,该空不填)。
用含a的代数式表达,若不能,该空不填)。
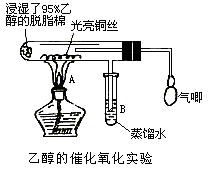 (1)甲同学其实验操作为:预先使棉花团浸透乙醇,并按下图搭好实验装置;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。
(1)甲同学其实验操作为:预先使棉花团浸透乙醇,并按下图搭好实验装置;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。