题目内容
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标)和加入铁粉的物质的量(横坐标)之间的关系如图所示,则原溶液中Fe(NO3)3、 Cu(NO3)2、HNO3物质的量浓度之比为
| A.1∶1∶1 | B.3∶3∶8 | C.1∶3∶1 | D.1∶1∶4 |
B
解析试题分析:先得比较这三种氧化剂的氧化性强弱:HNO3>Fe(NO3)3>Cu(NO3)2。反应中所涉及到的方程式为:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
1mol 4mol 1mol
Fe+2Fe(NO3)3=3Fe(NO3)2
1mol 2mol 3mol
Fe+Cu(NO3)2=Fe(NO3)2+Cu
1mol 1mol 1mol
从以上关系可以看出,n(HNO3)︰n(Fe(NO3)3)︰n(Cu(NO3)2)=1︰1︰4又因为同在一个溶液中,
所以:c(HNO3)︰c(Fe(NO3)3)︰c(Cu(NO3)2)=1︰1︰4
考点:氧化还原反应中的竞争反应的有关知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下列氧化还原反应中,水作为氧化剂的是( )
A.CO+H2O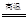 CO2+H2 CO2+H2 | B.Cl2+H2O=HCl+HClO |
| C.2Na2O2+2H2O=4NaOH+O2↑ | D.2F2+2H2O=4HF+O2 |
常温下,下列三个反应都能进行:2NaW+X2=2NaX+W2,2NaY+W2=2NaW+Y2,2KX+Z2=2KZ+X2,由此得出正确的结论是
| A.X-、Y-、Z-、W- 中Z- 的还原性最强 | B.2Z-+Y2 = 2Y-+Z2能进行 |
| C.X2、Y2、Z2、W2中Z2的氧化性最强 | D.还原性X-﹥Y- |
人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,主要由于维生素C具有
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
下列反应中,水作还原剂的是
| A.CO2+H2O=H2CO3 | B.Na2O+H2O=2NaOH |
| C.2Na+2H2O=2NaOH+H2↑ | D.2F2+2H2O=4HF+O2 |
下列反应中必须加入还原剂才能进行的是
| A.Zn→Zn2+ | B.H2→H2O | C.CaO→Ca(OH)2 | D.CuO→Cu |
下列变化中,需要加入氧化剂才能实现的是( )
| A.HCl→H2 | B.FeO→Fe2+ | C.SO2→SO3 | D.CO32-→CO2 |
含铬Cr2O72-废水用硫亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
| A.消耗硫酸亚铁铵的物质量为n(3x+1)mol | B.处理废水中Cr2O72-的物质量为 mol mol |
| C.反应中发生转移的电子数为1.5nxmol | D.在FeO·FeyCrxO3中3x=y |